Elektrónový obal atómu sodíka obsahuje energetické hladiny. Štruktúra elektrónových obalov atómov. Otázky a úlohy

Počet elektrónov v atóme sa rovná náboju jadra. Jadrový náboj je poradové číslo prvku v periodickej tabuľke. V dôsledku toho majú atómy každého nasledujúceho chemického prvku v periodickej tabuľke o jeden elektrón viac ako ten predchádzajúci.
Pri opise elektrónovej štruktúry atómu uveďte, ako sú jeho elektróny rozložené na energetických úrovniach. Elektróny najskôr obsadzujú úrovne s nižšou energiou, potom s vyššou energiou. Takže najskôr je naplnená prvá energetická hladina, ak je viac elektrónov, potom druhý, tretí atď. Počet energetických hladín v atómoch je určený počtom obdobia, v ktorom chemický prvok, ku ktorému atóm patrí.
Na prvej energetickej úrovni môžu byť iba dva elektróny. Preto v prvom období existujú iba dva chemické prvky - vodík a hélium. Keď sa na určitej úrovni nachádza iba maximálny možný počet elektrónov, potom sa hovorí, že táto úroveň je úplná. Prvá energetická úroveň je teda úplná pre všetky prvky okrem vodíka.
Pre prvky druhého obdobia sa druhá energetická úroveň postupne plní. Na druhej energetickej úrovni môže byť maximálne 8 elektrónov. Preto v druhom období existuje osem chemických prvkov.
Na tretej energetickej úrovni môže byť maximálne 18 elektrónov. V treťom období je však táto úroveň externá. Na akejkoľvek externej úrovni nemôže byť viac ako 8 elektrónov. Preto je v tretej perióde tretia energetická úroveň naplnená iba do 8 elektrónov vrátane, a preto tretia perióda, rovnako ako druhá perióda, obsahuje iba 8 chemických prvkov.
Vo štvrtom období tretia energetická úroveň už nie je vonkajšia, preto je naplnená až do 18 elektrónov vrátane. Prvé dva prvky 4. obdobia (K, Ca) napĺňajú hladinu vonkajšej energie. Draslík má teda jeden elektrón a pre vápnik 2. Ďalej pre prvky od škandia (Sc) po zinok (Zn) je tretia energetická hladina naplnená a dva elektróny zostávajú na vonkajšom. Po zinku s gáliom (Ga) je štvrtá energetická hladina opäť naplnená až 8 elektrónmi pre kryptón (Kr).
Všeobecne je maximálny počet elektrónov na každej energetickej úrovni určený vzorcom 2n2, kde n je počet úrovní. Ak je úroveň druhá, potom 2 * 2 2 \u003d 8, a ak tretia, potom 2 * 3 2 \u003d 18.
Elektróny s najvyššou energiou určujú chemické vlastnosti atómov a nazývajú sa valenčné. V hlavných podskupinách sú valenčné elektróny vonkajšou úrovňou a ich počet je určený počtom skupín. Preto sú vlastnosti prvkov jednej podskupiny podobné.
Vlastnosti atómov závisia od počtu valenčných elektrónov. Kovy ich majú málo a nekovy veľa.
6.6. Vlastnosti elektronickej štruktúry atómov chrómu, medi a niektorých ďalších prvkov
Ak ste sa pozorne pozreli na prílohu 4, pravdepodobne ste si všimli, že v atómoch niektorých prvkov je narušená postupnosť plnenia orbitálov elektrónmi. Niekedy sa tieto porušenia nazývajú „výnimky“, ale nie sú - neexistujú žiadne výnimky zo zákonov prírody!
Prvým prvkom s týmto porušením je chróm. Uvažujme podrobnejšie o jeho elektronickej štruktúre (obr. 6.16 a). Atóm chrómu má 4 s-úroveň nie dve, ako by jeden čakal, ale iba jeden elektrón. Ale o 3 d-úroveň piatich elektrónov a táto úroveň sa zaplní po 4 s- podúrovňa (pozri obr. 6.4). Aby sme pochopili, prečo sa to deje, pozrime sa, čo sú elektrónové oblaky 3 dje podúrovňou tohto atómu.
Každý z piatich 3 d-clony sú v tomto prípade tvorené jedným elektrónom. Ako už viete z § 4 tejto kapitoly, celkový elektrónový oblak týchto piatich elektrónov má sférický tvar alebo, ako sa hovorí, sférický symetrický. Povahou distribúcie elektrónovej hustoty v rôznych smeroch je to podobné ako v prípade 1 s-EO. Ukázalo sa, že energia podúrovne, ktorej elektróny tvoria taký oblak, je menšia ako v prípade menej symetrického oblaku. V tomto prípade je energia orbitálov 3 d-úroveň sa rovná energii 4 s-orbitálny. Keď je narušená symetria, napríklad keď sa objaví šiesty elektrón, energia orbitálov je 3 d- podúroveň sa opäť stáva väčšou ako energia 4 s-orbitálny. Preto má atóm mangánu opäť druhý elektrón o 4 s-AO.
Spoločný oblak akejkoľvek podúrovne naplnenej elektrónmi, polovičnými aj úplnými, má sférickú symetriu. Pokles energie má v týchto prípadoch všeobecný charakter a nezávisí od toho, či je niektorá podúroveň polovičná alebo úplne naplnená elektrónmi. A ak áno, potom by sme mali hľadať ďalšie porušenie v atóme, do elektrónového obalu, ktorého deviaty „prichádza“ posledný d-elektrón. Atóm medi má v skutočnosti 3 d-úroveň 10 elektrónov a na 4 s- existuje iba jedna podúroveň (obr. 6.16 b).
Pokles energie orbitálov úplne alebo na polovicu naplnenej podúrovne je príčinou mnohých dôležitých chemických javov, s ktorými sa oboznámite.
6.7. Vonkajšie a valenčné elektróny, orbitaly a podúrovne
V chémii sa vlastnosti izolovaných atómov spravidla neštudujú, pretože takmer všetky atómy, ktoré sú súčasťou rôznych látok, vytvárajú chemické väzby. Chemické väzby vznikajú pri interakcii elektrónových obalov atómov. Pre všetky atómy (okrem vodíka) sa nie všetky elektróny podieľajú na tvorbe chemických väzieb: bór má tri elektróny z piatich, uhlík štyri zo šiestich a napríklad bárium dva z päťdesiatich šiestich. Tieto „aktívne“ elektróny sa nazývajú valenčné elektróny.
Niekedy sú valenčné elektróny zamieňané s externýelektróny, ktoré nie sú to isté.
Elektrónové mraky vonkajších elektrónov majú maximálny polomer (a maximálnu hodnotu hlavného kvantového čísla).

Sú to predovšetkým vonkajšie elektróny, ktoré sa podieľajú na tvorbe väzby, už len preto, že keď sa atómy priblížia k sebe, elektrónové oblaky tvorené týmito elektrónmi prichádzajú do styku predovšetkým. Ale spolu s nimi sa časť elektrónov môže podieľať na tvorbe väzby. pre-externý(predposledná) vrstva, ale iba ak majú energiu, ktorá sa veľmi nelíši od energie vonkajších elektrónov. Oba tieto a ďalšie elektróny atómu sú valenčné. (V lantanoidoch a aktinidoch sú dokonca aj niektoré „predexterné“ elektróny valenčné).
Energia valenčných elektrónov je oveľa väčšia ako energia iných elektrónov atómu a valenčné elektróny sa navzájom navzájom podstatne menej líšia.
Vonkajšie elektróny sú vždy valenčné iba vtedy, ak atóm môže vôbec vytvárať chemické väzby. Oba elektróny atómu hélia sú teda vonkajšie, ale nemožno ich nazvať valenčné, pretože atóm hélia vôbec nevytvára žiadne chemické väzby.
Valenčné elektróny obsadzujú valenčné orbitaly, ktoré zase tvoria valenčné podúrovne.

Ako príklad si vezmime atóm železa, ktorého elektronická konfigurácia je znázornená na obr. 6.17. Z elektrónov atómu železa je maximálne hlavné kvantové číslo ( n\u003d 4) majú iba dve 4 s-elektrón. Preto sú to oni, ktorí sú vonkajšími elektrónmi tohto atómu. Vonkajšie orbitaly atómu železa sú všetky orbitaly s n \u003d 4 a vonkajšie podúrovne sú všetky podúrovne tvorené týmito orbitalmi, to znamená 4 s-,
4p-, 4d- a 4 f-EPU.
Vonkajšie elektróny sú vždy valenčné, teda 4 s-elektróny atómu železa - valenčné elektróny. A ak áno, tak 3 d- elektróny s mierne vyššou energiou budú tiež valenčné. Na vonkajšej úrovni atómu železa sa okrem naplnenej 4 s-AO, stále sú zadarmo 4 p-, 4d- a 4 f-AO. Všetky sú vonkajšie, ale sú medzi nimi iba 4 valencie. r-AO, pretože energia ostatných orbitálov je oveľa vyššia a vzhľad elektrónov na týchto orbitáloch nie je pre atóm železa prospešný.
Takže atóm železa
externá elektronická úroveň - štvrtá,
vonkajšie podúrovne - 4 s-, 4p-, 4d- a 4 f-EPU,
vonkajšie orbitály - 4 s-, 4p-, 4d- a 4 f-AO,
vonkajšie elektróny - dva 4 s-elektrón (4 s 2),
vonkajšia elektrónová vrstva - štvrtá,
externý elektronický cloud - 4 s-EO
valenčné podúrovne - 4 s-, 4p- a 3 d-EPU,
valenčné orbitaly - 4 s-, 4p- a 3 d-AO,
valenčné elektróny - dva 4 s-elektrón (4 s 2) a šesť 3 d-elektróny (3 d 6).
Valenčné podúrovne môžu byť čiastočne alebo úplne naplnené elektrónmi, alebo môžu spravidla zostať voľné. S nárastom jadrového náboja sa hodnoty energie všetkých podúrovní znižujú, ale v dôsledku vzájomnej interakcie elektrónov klesá energia rôznych podúrovní s rôznymi „rýchlosťami“. Energia úplne naplnená d- a f- podúrovne sa znižujú natoľko, že prestávajú byť valenčné.
Ako príklad uveďme atómy titánu a arzénu (obr. 6.18).

V prípade atómu titánu 3 d-EPU je naplnená elektrónmi iba čiastočne a jej energia je väčšia ako energia 4 s- EPU a 3 d-elektróny sú valenčné. Atóm arzénu má 3 d-EU je úplne naplnená elektrónmi a jej energia je podstatne menšia ako energia 4 s-EPU, a teda 3 d-elektróny nie sú valenčné.
V uvedených príkladoch sme analyzovali valenčná elektronická konfiguráciaatómy titánu a arzénu.
Valenčná elektronická konfigurácia atómu je znázornená ako valenčný elektronický vzorec, alebo vo forme energetický diagram valenčných podúrovní.
VALENČNÉ ELEKTRÓNY, VONKAJŠIE ELEKTRÓNY, VALENTNÉ EPU, VALENT AO, VALENTNÁ ELEKTRONICKÁ KONFIGURÁCIA ATÓMU, VALENČNÉ ELEKTRONICKÉ FORMULÁRY, VALENČNÝ PODÚROVEŇ.
1. Na energetických diagramoch, ktoré ste zostavili, a v úplných elektronických vzorcoch atómov Na, Mg, Al, Si, P, S, Cl, Ar označte vonkajšie a valenčné elektróny. Vytvorte valenčné elektronické vzorce týchto atómov. Na energetických diagramoch zvýraznite časti zodpovedajúce energetickým diagramom valenčných podúrovní.
2. Čo je bežné medzi elektronickými konfiguráciami atómov a) Li a Na, B a Al, O a S, Ne a Ar; b) Zn a Mg, Sc a Al, Cr a S, Ti a Si; c) H a He, Li a O, K a Kr, Sc a Ga. Aké sú ich rozdiely
3. Koľko valenčných úrovní v elektrónovom obale atómu každého z prvkov: a) vodík, hélium a lítium, b) dusík, sodík a síra, c) draslík, kobalt a germánium
4. Koľko valenčných orbitálov je úplne vyplnených a) bórom, b) fluórom, c) atómom sodíka?
5. Koľko orbitálov s nespárovaným elektrónom v atóme a) bóru, b) fluóru, c) železa
6. Koľko voľných vonkajších orbitálov má atóm mangánu? A koľko voľných valencií?
7. Na nasledujúcu lekciu si pripravte pás papiera široký 20 mm, rozdeľte ho na bunky (20 × 20 mm) a na tento pásik naneste prirodzenú škálu prvkov (od vodíka po meitnerium).
8. Do každej bunky vložte symbol prvku, jeho poradové číslo a valenčný elektronický vzorec, ako je znázornené na obr. 6.19 (použite dodatok 4).

6.8. Systematizácia atómov podľa štruktúry ich elektronických schránok
Systemizácia chemických prvkov je založená na prirodzenej sérii prvkov
a princíp podobnosti elektronických schránokich atómy.
Prirodzenú škálu chemických prvkov už poznáte. Teraz sa oboznámime s princípom podobnosti elektronických škrupín.
Ak vezmeme do úvahy valenčné elektronické vzorce atómov v NRE, je ľahké zistiť, že pre niektoré atómy sa líšia iba hodnotami hlavného kvantového čísla. Napríklad 1 s 1 pre vodík, 2 s 1 pre lítium, 3 s 1 pre sodík atď. Alebo 2 s 2 2p 5 pre fluór, 3 s 2 3p 5 pre chlór, 4 s 2 4p 5 pre bróm atď. To znamená, že vonkajšie oblasti oblakov valenčných elektrónov takýchto atómov majú veľmi podobný tvar a líšia sa iba veľkosťou (a samozrejme hustotou elektrónov). A ak je to tak, potom možno nazvať elektrónové oblaky takýchto atómov a zodpovedajúce valenčné konfigurácie páči sa mi to... Pre atómy rôznych prvkov s podobnou elektronickou konfiguráciou môžeme písať všeobecné valenčné elektronické vzorce: ns 1 v prvom prípade a ns 2 np 5 v druhej. Pohybujúc sa po prirodzenej sérii prvkov môžeme nájsť ďalšie skupiny atómov s podobnými valenčnými konfiguráciami.
Touto cestou, atómy s podobnou valenčnou elektrónovou konfiguráciou sa pravidelne nachádzajú v prirodzenej sérii prvkov.
Toto je princíp podobnosti elektronických škrupín.
Pokúsme sa určiť druh tejto pravidelnosti. Použijeme na to prírodný rad prvkov, ktoré ste vytvorili.

ERE začína vodíkom, ktorého valenčný elektronový vzorec je 1 s 1. Pri hľadaní podobných valenčných konfigurácií rozstrihneme prirodzenú sériu prvkov pred prvkami pomocou spoločného valenčného elektronického vzorca ns 1 (t.j. pred lítiom, pred sodíkom atď.). Dostali sme takzvané „periódy“ prvkov. Pridajme výsledné „bodky“ tak, aby sa z nich stali riadky tabuľky (pozri obr. 6.20). Výsledkom bude, že iba atómy v prvých dvoch stĺpcoch tabuľky budú mať podobnú elektronickú konfiguráciu.
Pokúsme sa dosiahnuť podobnosť valenčných elektronických konfigurácií v ďalších stĺpcoch tabuľky. Aby sme to dosiahli, vyrezali sme zo 6. a 7. periódy prvky s číslami 58 - 71 a 90 - 103 (sú naplnené 4 f- a 5 f- podúrovne) a umiestnite ich pod stôl. Presuňte vodorovne symboly zvyšných prvkov, ako je to znázornené na obrázku. Potom budú mať atómy prvkov stojacich v jednom stĺpci tabuľky podobné valenčné konfigurácie, ktoré možno vyjadriť všeobecnými valenčnými elektronickými vzorcami: ns 1 , ns 2 , ns 2 (n–1)d 1 , ns 2 (n–1)d 2 a tak ďalej až do ns 2 np 6. Všetky odchýlky od všeobecných valenčných vzorcov sú z rovnakých dôvodov ako v prípade chrómu a medi (pozri odsek 6.6).
Ako vidíte, pomocou ERE a uplatnenia princípu podobnosti elektronických schránok sme boli schopní systematizovať chemické prvky. Takýto systém chemických prvkov sa nazýva prirodzené, pretože je založený výlučne na prírodných zákonoch. Tabuľka, ktorú sme získali (obr. 6.21), je jedným zo spôsobov, ako graficky znázorniť prirodzený systém prvkov, a je tzv dlhodobá tabuľka chemických prvkov.

ZÁSADA PODOBNOSTI ELEKTRONICKÝCH PLÁŠT, PRÍRODNÝ SYSTÉM CHEMICKÝCH PRVKOV ("PERIODICKÝ" SYSTÉM), TABUĽKA CHEMICKÝCH PRVKOV.
6.9. Dlhodobá tabuľka chemických prvkov
Pozrime sa podrobnejšie na štruktúru dlhodobej tabuľky chemických prvkov.
Riadky v tejto tabuľke, ako už viete, sa nazývajú „bodky“ prvkov. Bodky sú očíslované arabskými číslicami od 1 do 7. V prvej bodke sú iba dva prvky. Druhá a tretia tretina, každá obsahuje osem prvkov, sa nazývajú krátkyobdobia. Štvrtá a piata perióda, každá obsahuje 18 prvkov, sa nazýva dlhoobdobia. Šiesta a siedma perióda, každá obsahujúca 32 prvkov, sa nazýva extra dlhé obdobia.
Stĺpce v tejto tabuľke sa nazývajú v skupináchprvkov. Čísla skupín sú označené rímskymi číslicami latinskými písmenami A alebo B.
Prvky niektorých skupín majú svoje vlastné bežné (skupinové) názvy: prvky skupiny IA (Li, Na, K, Rb, Cs, Fr) - alkalické prvky(alebo prvky alkalických kovov); Prvky skupiny IIA (Ca, Sr, Ba a Ra) - prvky alkalických zemín(alebo prvky kovov alkalických zemín) (názov „alkalické kovy“ a kovy alkalických zemín “označuje jednoduché látky tvorené zodpovedajúcimi prvkami a nemali by sa používať ako názvy skupín prvkov); prvky skupiny VIA (O, S, Se, Te, Po) - chalkogény, prvky skupiny VIIA (F, Cl, Br, I, At) - halogény, prvky skupiny VIIIA (He, Ne, Ar, Kr, Xe, Rn) - prvky vzácneho plynu(Tradičný názov „vzácne plyny“ označuje aj jednoduché látky)
Volajú sa prvky s poradovými číslami 58 - 71 (Ce - Lu), ktoré sú zvyčajne vyvedené na spodok tabuľky lantanoidy („nasledujúci lantán“) a prvky s radovými číslami 90 - 103 (Th - Lr) - aktinidy („nasledujúce po aktiniu“). Existuje variant tabuľky s dlhodobým obdobím, v ktorom lantanoidy a aktinidy nie sú vystrihnuté z NRE, ale zostávajú na svojom mieste v superdlhých obdobiach. Táto tabuľka sa niekedy nazýva superdlhodobé obdobie.
Tabuľka dlhého obdobia je rozdelená na štyri blokovať(alebo oddiel).
s-blok Zahŕňa prvky skupín IA a IIA so všeobecnými valenčnými elektronickými vzorcami ns 1 a ns 2
(s-prvky).
r-blok zahŕňa prvky zo skupiny IIIA až VIIIA so všeobecnými valenčnými elektronickými vzorcami z ns 2 np 1 až ns 2 np 6 (p-prvky).
d-blok zahŕňa prvky zo skupiny IIIB do IIB so všeobecnými valenčnými elektronickými vzorcami z ns 2 (n–1)d 1 až ns 2 (n–1)d 10 (d-prvky).
f-blok zahŕňa lantanoidy a aktinidy ( f-prvkov).

Prvky s- a p-bloky tvoria A-skupiny a prvky d -blok - B-skupina systému chemických prvkov. Všetky f-prvky sú formálne zahrnuté do skupiny IIIB.
Prvky prvého obdobia - vodík a hélium - sú s-prvky a môžu byť umiestnené v skupinách IA a IIA. Ale hélium sa častejšie umiestňuje do skupiny VIIIA ako prvok, ktorý končí obdobie, ktoré úplne zodpovedá jeho vlastnostiam (hélium, rovnako ako všetky ostatné jednoduché látky tvorené prvkami tejto skupiny, je ušľachtilý plyn). Na druhej strane, vodík sa často nachádza v skupine VIIA, pretože svojimi vlastnosťami je oveľa bližšie k halogénom ako k alkalickým prvkom.
Každá z periód systému začína prvkom s valenčnou konfiguráciou atómov ns 1, pretože práve z týchto atómov začína tvorba ďalšej elektrónovej vrstvy a končí sa prvkom s valenčnou konfiguráciou atómov. ns 2 np 6 (okrem prvého obdobia). Takto je možné na energetickom diagrame ľahko rozlíšiť skupiny podúrovní, ktoré sú naplnené elektrónmi od atómov každej z periód (obr. 6.22). Vykonajte túto prácu so všetkými podúrovňami zobrazenými vo vašej kópii obrázka 6.4. Podúrovne zvýraznené na obrázku 6.22 (okrem úplne vyplnených d- a f- podúrovne) sú valenčné pre atómy všetkých prvkov daného obdobia.
Vzhľad v obdobiach s-, p-, d- alebo f-prvky sa úplne zhodujú s postupnosťou plnenia s-, p-, d- alebo f- podúrovne elektrónov. Táto vlastnosť systému prvkov umožňuje, s vedomím obdobia a skupiny, ktorej je tento prvok súčasťou, okamžite zapísať jeho valenčný elektronický vzorec.
TABUĽKA DLHODOBÝCH CHEMICKÝCH PRVKOV, BLOKOV, OBDOBÍ, SKUPÍN, ALKALÍNOVÝCH PRVKOV, ALKALÍNOVÝCH PRVKOV NA ZEMI, CHALCOGÉNOV, HALOGÉNOV, PRVKOV BEZPLYNOVÝCH PLYNOV, LATHANOIDOV.
Zapíšte si všeobecné valenčné elektronické vzorce atómov prvkov a) skupín IVA a IVB, b) skupín IIIA a VIIB?
2. Čo je bežné medzi elektronickými konfiguráciami atómov prvkov skupín A a B? Čím sa líšia?
3. Koľko skupín prvkov je zahrnutých v a) s-blok, b) r-blok, c) d-blok?
4. Pokračujte na obrázku 30 smerom k zvyšovaniu energie nižších úrovní a vyberte skupiny nižších úrovní, ktoré sú naplnené elektrónmi v 4., 5. a 6. období.
5. Uveďte valenčné podúrovne a) vápnika, b) fosforu, c) titánu, d) chlóru, e) sodíka. 6. Formulujte, ako sa navzájom líšia prvky s-, p- a d.
7. Vysvetlite, prečo sa príslušnosť atómu k ľubovoľnému prvku určuje podľa počtu protónov v jadre, a nie podľa hmotnosti tohto atómu.
8. Pre atómy lítia, hliníka, stroncia, selénu, železa a olova zostavte valenciu, úplné a skrátené elektronické vzorce a nakreslite energetické diagramy valenčných podúrovní. 9. Atómy ktorých prvkov zodpovedajú týmto valenčným elektronickým vzorcom: 3 s 1 , 4s 1 3d 1, 2s 2 2 p 6 , 5s 2 5p 2 , 5s 2 4d 2 ?
6.10. Typy elektronických vzorcov atómu. Algoritmus ich kompilácie
Na rôzne účely potrebujeme poznať úplnú alebo valenčnú konfiguráciu atómu. Každá z týchto elektronických konfigurácií môže byť reprezentovaná vzorcom aj energetickým diagramom. Tj. úplná elektronická konfigurácia atómuvyjadrený kompletný elektronický vzorec atómualebo kompletný energetický diagram atómu... Na druhej strane valenčná elektrónová konfigurácia atómuvyjadrený valencia(alebo, ako sa často nazýva, “ krátky ") elektronický vzorec atómualebo diagram valenčných podúrovní atómu(obr. 6.23).

Kedysi sme vyrábali elektronické vzorce atómov pomocou radových čísel prvkov. V tomto prípade sme z energetického diagramu určili postupnosť plnenia podúrovní elektrónmi: 1 s, 2s,
2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p,
6s, 4f, 5d, 6p, 7s atď. A len tak, že si napíšeme kompletný elektronický vzorec, môžeme si zapísať valenčný vzorec.
Najčastejšie sa používa valenčný elektronický vzorec atómu, ktorý je vhodnejšie zapisovať na základe polohy prvku v sústave chemických prvkov podľa súradníc perióda - skupina.
Zvážme podrobne, ako sa to robí pre prvky. s-, p- a d-bloky.
Pre položky s-valenčný blokový elektronický vzorec atómu sa skladá z troch symbolov. Vo všeobecnosti to možno napísať takto:
Na prvom mieste (namiesto veľkej bunky) sa umiestni číslo periódy (rovnaké ako ich hlavné kvantové číslo) s-elektróny) a na treťom (v hornom indexe) je číslo skupiny (rovná sa počtu valenčných elektrónov). Ako príklad môžeme uviesť atóm horčíka (tretie obdobie, skupina IIA):
Pre položky p-valenčný blokový elektronický vzorec atómu sa skladá zo šiestich symbolov:
![]()
Tu sa namiesto veľkých buniek umiestňuje aj číslo periódy (rovnaké ako hlavné kvantové číslo z nich) s- a p-elektróny) a číslo skupiny (rovná sa počtu valenčných elektrónov) sa rovná súčtu horných indexov. Za atóm kyslíka (2. perióda, skupina VIA) dostaneme:
2s 2 2p 4 .
Valenčný elektronický vzorec väčšiny prvkov d-blok sa dá napísať takto:
Rovnako ako v predchádzajúcich prípadoch, aj tu sa namiesto prvej bunky vloží číslo periódy (rovná sa hlavnému kvantovému počtu týchto s-elektróny). Ukázalo sa, že číslo v druhej bunke je o jedno menej, pretože ich je hlavný kvantový počet d-elektróny. Číslo skupiny sa tu rovná aj súčtu indexov. Príklad - valenčný elektronový vzorec titánu (4. perióda, skupina IVB): 4 s 2 3d 2 .
Číslo skupiny sa rovná súčtu indexov a pre prvky skupiny VIB, ale, ako si pamätáte, na valencii s- existuje iba jedna elektrónová podúroveň a všeobecný valenčný elektronický vzorec ns 1 (n–1)d päť . Preto je valenčný elektronický vzorec, napríklad molybdén (5. obdobie) - 5 s 1 4d 5 .
Rovnako ľahké je zostaviť valenčný elektronický vzorec ľubovoľného prvku skupiny IB, napríklad zlata (6. obdobie)\u003e -\u003e 6 s 1 5d 10, ale v tomto prípade si to treba uvedomiť d- elektróny atómov prvkov tejto skupiny stále zostávajú valenčné a niektoré z nich sa môžu podieľať na tvorbe chemických väzieb.
Všeobecný valenčný elektronický vzorec pre atómy prvkov skupiny IIB je ns 2 (n – 1)d desať. Preto je valenčný elektronový vzorec napríklad pre atóm zinku 4 s 2 3d 10 .
Valenčné elektronické vzorce prvkov prvej triády (Fe, Co a Ni) sa tiež podriaďujú všeobecným pravidlám. Železo, prvok skupiny VIIIB, má valenčný elektronový vzorec 4 s 2 3d 6. Atóm kobaltu jeden má d-elektrón väčší (4 s 2 3d 7) a pre atóm niklu - dva (4 s 2 3d 8).
Použitím iba týchto pravidiel na písanie valenčných elektronických vzorcov je nemožné zostaviť elektronické vzorce pre atómy niektorých d-prvky (Nb, Ru, Rh, Pd, Ir, Pt), pretože ich plnenie valenčných podúrovní elektrónmi v dôsledku tendencie k vysoko symetrickým elektrónovým škrupinám má niektoré ďalšie vlastnosti.
Ak poznáte valenčný elektronický vzorec, môžete si zapísať celý elektronický vzorec atómu (pozri nižšie).
Namiesto ťažkopádnych úplných elektronických vzorcov človek často píše skrátené elektronické vzorceatómy. Na ich zloženie v elektronickom vzorci sú vybrané všetky elektróny atómu okrem valenčných, ich symboly sú umiestnené v hranatých zátvorkách a časť elektronického vzorca zodpovedajúca elektronickému vzorcu atómu posledného prvku predchádzajúceho obdobia (prvok tvoriaci vzácny plyn) je nahradená symbolom tohto atómu.
Príklady rôznych elektronických vzorcov sú uvedené v tabuľke 14.
Tabuľka 14. Príklady elektronických vzorcov atómov
Elektronické vzorce |
|||
Skrátené |
Valencia |
||
1s 2 2s 2 2p 3 |
2s 2 2p 3 |
2s 2 2p 3 |
|
1s 2 2s 2 2p 6 3s 2 3p 5 |
3s 2 3p 5 |
3s 2 3p 5 |
|
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 |
4s 2 3d 5 |
4s 2 3d 5 |
|
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 3 |
4s 2 4p 3 |
4s 2 4p 3 |
|
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 |
4s 2 4p 6 |
4s 2 4p 6 |
|
Algoritmus na zostavovanie elektronických vzorcov atómov (napríklad atómu jódu)
№ |
Prevádzka |
Výsledok |
|
Určte súradnice atómu v tabuľke prvkov. |
5. obdobie, skupina VIIA |
||
Vytvorte valenčný elektronický vzorec. |
5s 2 5p 5 |
||
Doplňte symboly vnútorných elektrónov v poradí, ktoré vypĺňajú podúrovne. |
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 5 |
||
Ak vezmeme do úvahy pokles energie úplne naplneného d- a f- Podúrovne, zapíšte si kompletný elektronický vzorec. |
|
||
Všimnite si valenčné elektróny. |
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 5 |
||
Zvýraznite elektrónovú konfiguráciu predchádzajúceho atómu vzácneho plynu. |
|||
Zapíšte si skrátený elektronický vzorec, ktorý skombinujte všetky do hranatých zátvoriek neviazaný elektróny. |
5s 2 5p 5 |
Poznámky
1. Pre prvky 2. a 3. periódy vedie tretia operácia (bez štvrtej) k úplnému elektronickému vzorcu.
2. (n – 1)d 10 -Elektróny zostávajú valenčné na atómoch prvkov skupiny IB.
KOMPLETNÝ ELEKTRONICKÝ FORMULÁR, VALENČNÝ ELEKTRONICKÝ FORMULÁR, ZNÍŽENÝ ELEKTRONICKÝ FORMULÁR, ALGORITMUS PRE ZLOŽENIE ELEKTRONICKÝCH FORMULÁROV ATÓMOV.
1. Vytvorte valenčný elektronický vzorec atómu prvku a) druhú periódu tretej skupiny A, b) tretiu periódu druhej skupiny A, c) štvrtú periódu štvrtej skupiny A.
2. Vytvorte skrátené elektronické vzorce pre atómy horčíka, fosforu, draslíka, železa, brómu a argónu.
6.11. Krátkodobá tabuľka chemických prvkov
Za viac ako 100 rokov, ktoré uplynuli od objavenia prirodzeného systému prvkov, bolo navrhnutých niekoľko stoviek najrôznejších tabuliek, ktoré tento systém graficky odrážajú. Z nich je okrem tabuľky s dlhým obdobím najrozšírenejšia takzvaná tabuľka prvkov s krátkym obdobím od DI Mendelejeva. Tabuľka s krátkymi periódami sa získa z tabuľky s dlhými periódami, ak sa 4., 5., 6. a 7. perióda prereže pred prvkami skupiny IB, posunie sa od seba a výsledné riadky sa preložia, ako sme zvykli sčítať periódy. Výsledok je uvedený na obrázku 6.24.

Lantanidy a aktinidy sú tiež umiestnené pod hlavným stolom.
IN skupinytáto tabuľka obsahuje prvky, ktorých atómy sú rovnaký počet valenčných elektrónovbez ohľadu na to, na akých orbitáloch sa tieto elektróny nachádzajú. Teda prvky chlór (typický prvok, ktorý vytvára nekov; 3 s 2 3p 5) a mangán (prvok tvoriaci kov; 4 s 2 3d 5), ktoré nevyzerajú ako elektronické puzdrá, patria do rovnakej siedmej skupiny. Potreba rozlišovať medzi takými prvkami vás núti vyberať v skupinách podskupiny: hlavný- analógy A-skupín tabuľky s dlhým obdobím a strane - analógy B-skupín. Na obrázku 34 sú symboly prvkov hlavných podskupín posunuté doľava a prvky sekundárnych podskupín sú posunuté doprava.
Je pravda, že také usporiadanie prvkov v tabuľke má aj svoje výhody, pretože to je počet valenčných elektrónov, ktorý primárne určuje valenčné schopnosti atómu.
Dlhodobá tabuľka odráža vzorce elektronickej štruktúry atómov, podobnosť a vzorce zmien vlastností jednoduchých látok a zlúčenín podľa skupín prvkov, prirodzenú zmenu množstva fyzikálnych veličín charakterizujúcich atómy, jednoduché látky a zlúčeniny v celej sústave prvkov a oveľa viac. Krátkodobá tabuľka je z tohto hľadiska menej výhodná.
TABUĽKA KRÁTKEHO OBDOBIA, HLAVNÉ PODskupiny, BOČNÉ PODskupiny.
1. Preveďte tabuľku s dlhými periodami, ktorú ste vytvorili z prirodzenej série prvkov, na tabuľku s krátkym obdobím. Zvrátiť transformáciu.
2. Je možné zostaviť všeobecný valenčný elektronický vzorec atómov prvkov jednej skupiny tabuľky krátkych periód? Prečo?
6.12. Veľkosti atómov. Orbitálne polomery
.Atóm nemá jasné hranice. Čo sa považuje za veľkosť izolovaného atómu? Jadro atómu je obklopené elektrónovým plášťom a obal tvoria elektrónové oblaky. Veľkosť EO je charakterizovaná polomerom r eo. Všetky oblaky vo vonkajšej vrstve majú približne rovnaký polomer. Preto možno veľkosť atómu charakterizovať týmto polomerom. To sa nazýva orbitálny polomer atómu(r 0).
Hodnoty orbitálnych polomerov atómov sú uvedené v dodatku 5.
Polomer EO závisí od náboja jadra a od toho, v ktorej obežnej dráhe sa nachádza elektrón, ktorý vytvára tento mrak. Preto orbitálny polomer atómu závisí od rovnakých charakteristík.
Zvážte elektrónové obaly atómov vodíka a hélia. V atóme vodíka aj v atóme hélia sú elektróny na hodnote 1 s-AO a ich oblaky by mali rovnakú veľkosť, keby boli náboje jadier týchto atómov rovnaké. Ale náboj jadra atómu hélia je dvakrát väčší ako náboj jadra atómu vodíka. Podľa Coulombovho zákona je príťažlivá sila pôsobiaca na každý z elektrónov atómu hélia dvojnásobná ako príťažlivá sila elektrónu k jadru atómu vodíka. Polomer atómu hélia musí byť preto oveľa menší ako polomer atómu vodíka. A je tu: r 0 (He) / r 0 (H) \u003d 0,291 E / 0,529 E 0,55.
Atóm lítia má vonkajší elektrón na hodnote 2 s-AO, to znamená, že vytvára oblak druhej vrstvy. Prirodzene, jeho polomer by mal byť väčší. Naozaj: r 0 (Li) \u003d 1,586 E.
Atómy zvyšných prvkov druhej periódy majú vonkajšie elektróny (a 2 sa 2 p) sa nachádzajú v tej istej druhej elektrónovej vrstve a jadrový náboj týchto atómov sa zvyšuje so zvyšujúcim sa sériovým číslom. Elektróny sú silnejšie priťahované k jadru a prirodzene sa zmenšujú polomery atómov. Toto uvažovanie by sme mohli zopakovať pre atómy prvkov iných období, ale s jedným objasnením: orbitálny polomer sa monotónne zmenšuje, až keď je naplnená každá z podúrovní.
Ale ak ignorujeme podrobnosti, potom je všeobecná povaha zmeny veľkosti atómov v sústave prvkov nasledovná: s nárastom sériového čísla v období sa zmenšujú orbitálne polomery atómov a v skupine sa zväčšujú. Najväčší atóm je atóm cézia a najmenší atóm hélia, ale z atómov prvkov, ktoré tvoria chemické zlúčeniny (hélium a neón ich netvoria), najmenší atóm fluóru.
Väčšina atómov prvkov, ktoré sú v prirodzenom rade po lantanoidoch, majú na základe všeobecných zákonov polomery obežných dráh o niečo menšie, ako by sa dalo čakať. Je to tak kvôli skutočnosti, že 14 lantanoidov sa nachádza medzi lantánom a hafniom v sústave prvkov, a preto je náboj jadra atómu hafnia 14 e viac ako lantán. Preto sú vonkajšie elektróny týchto atómov priťahované k jadru silnejšie, ako by boli priťahované pri absencii lantanidov (tento efekt sa často nazýva „kompresia lantanidu“).
Upozorňujeme, že pri prechode od atómov prvkov skupiny VIIIA k atómom prvkov skupiny IA sa orbitálny polomer náhle zvýši. V dôsledku toho sa naša voľba prvých prvkov každého obdobia (pozri § 7) ukázala ako správna.
ORBITÁLNY RÁDIUM ATÓMU, JEHO ZMENA V SYSTÉME PRVKOV.
1. Podľa údajov uvedených v dodatku 5 sa na grafický papier zakreslí graf závislosti orbitálneho polomeru atómu od ordinálneho čísla prvku pre prvky s Z od 1 do 40. Dĺžka horizontálnej osi je 200 mm, dĺžka vertikálnej osi je 100 mm.
2. Ako môžete charakterizovať vzhľad výslednej prerušovanej čiary?
6.13. Ionizačná energia atómu
Ak dodáte elektrónu v atóme ďalšiu energiu (ako sa to dá urobiť, dozviete sa to z kurzu fyziky), potom môže elektrón prejsť na iný AO, to znamená, že atóm bude v vzrušený stav... Tento stav je nestabilný a elektrón sa takmer okamžite vráti do pôvodného stavu a prebytočná energia sa uvoľní. Ale ak je energia dodaná elektrónu dostatočne veľká, môže sa elektrón úplne oddeliť od atómu, zatiaľ čo atóm ionizuje, to znamená, že sa zmení na kladne nabitý ión ( katión). Energia potrebná na to sa volá ionizačná energia atómu(E a).
Je dosť ťažké odtrhnúť elektrón z jedného atómu a zmerať na to potrebnú energiu, preto je prakticky určený a používaný molárna ionizačná energia(E a m).
Molárna ionizačná energia ukazuje, čo je najmenšia energia, ktorá je potrebná na oddelenie 1 mólu elektrónov od 1 mólu atómov (jeden elektrón od každého atómu). Táto hodnota sa zvyčajne meria v kilojouloch na mol. Hodnoty molárnej ionizačnej energie prvého elektrónu pre väčšinu prvkov sú uvedené v dodatku 6.
Ako závisí ionizačná energia atómu od polohy prvku v sústave prvkov, to znamená, ako sa mení v skupine a období?
Podľa fyzikálneho významu sa ionizačná energia rovná práci, ktorú je potrebné vynaložiť na prekonanie sily príťažlivosti elektrónu k atómu, keď sa elektrón pohybuje od atómu do nekonečnej vzdialenosti od neho.
kde q - elektrónový náboj, Q Je náboj katiónu zostávajúci po odstránení elektrónu a r o je orbitálny polomer atómu.
A qa Q - veličiny sú stále a môžeme z toho vyvodiť záver, že práca na separácii elektrónu Aa s ním ionizačná energia E a sú nepriamo úmerné orbitálnemu polomeru atómu.
Po analýze hodnôt orbitálnych polomerov atómov rôznych prvkov a zodpovedajúcich hodnôt ionizačnej energie uvedených v dodatkoch 5 a 6 sa môžete ubezpečiť, že vzťah medzi týmito hodnotami je blízky proporcionálnemu, ale trochu sa od neho líši. Dôvod, prečo náš záver veľmi nesúhlasí s experimentálnymi údajmi, je ten, že sme použili veľmi hrubý model, ktorý nezohľadňuje veľa významných faktorov. Ale aj tento hrubý model nám umožnil vyvodiť správny záver, že s nárastom orbitálneho polomeru klesá ionizačná energia atómu a naopak so zmenšením polomeru rastie.
Pretože sa orbitálny polomer atómov v období s nárastom poradového čísla zmenšuje, zvyšuje sa ionizačná energia. V skupine s nárastom ordinálneho čísla sa spravidla zvyšuje orbitálny polomer atómov a klesá ionizačná energia. Najväčšia molárna ionizačná energia sa nachádza v najmenších atómoch, atómoch hélia (2372 kJ / mol), a medzi atómami schopnými vytvárať chemické väzby, vo atómoch fluóru (1681 kJ / mol). Najmenší je pre najväčšie atómy, atómy cézia (376 kJ / mol). V systéme prvkov možno smer zvyšovania ionizačnej energie schematicky znázorniť nasledovne: 
V chémii je dôležité, aby ionizačná energia charakterizovala tendenciu atómu vzdať sa „svojich“ elektrónov: čím väčšia je ionizačná energia, tým menej je atóm náchylný vzdávať sa elektrónov, a naopak.
NADŠENÝ ŠTÁT, IONIZÁCIA, KATALÓG, IONIZAČNÁ ENERGIA, MOLÁRNA IONIZAČNÁ ENERGIA, ZMENA IONIZAČNEJ ENERGIE V SYSTÉME PRVKOV.
1. Pomocou údajov uvedených v dodatku 6 určite, koľko energie je potrebné vynaložiť, aby sa vzal jeden elektrón od všetkých atómov sodíka s celkovou hmotnosťou 1 g.
2. Pomocou údajov uvedených v dodatku 6 určite, koľkokrát je potrebné spotrebovať viac energie na odpojenie jedného elektrónu od všetkých atómov sodíka s hmotnosťou 3 g ako od všetkých atómov draslíka s rovnakou hmotnosťou. Prečo sa tento pomer líši od pomeru energií molárnej ionizácie tých istých atómov?
3. Podľa údajov uvedených v dodatku 6 zostavte graf závislosti molárnej ionizačnej energie od sériového čísla pre prvky s Z od 1 do 40. Rozmery grafu sú rovnaké ako v úlohe k predchádzajúcemu odseku. Zistite, či sa tento plán zhoduje s výberom „periód“ systému prvkov.
6.14. Elektrónová afinitná energia
.Druhou najdôležitejšou energetickou charakteristikou atómu je elektrónová afinitná energia(E od).
V praxi sa, podobne ako v prípade ionizačnej energie, zvyčajne používa zodpovedajúce molárne množstvo - molárna elektrónová afinitná energia().
Molárna energia afinity k elektrónu ukazuje, aká je energia uvoľnená, keď je jeden mól elektrónov pripojený k jednému mólu neutrálnych atómov (jeden elektrón ku každému atómu). Rovnako ako molárna ionizačná energia sa aj táto hodnota meria v kilojouloch na mol.
Na prvý pohľad sa môže zdať, že v tomto prípade by sa energia nemala uvoľňovať, pretože atóm je neutrálna častica a medzi neutrálnym atómom a záporne nabitým elektrónom neexistujú žiadne elektrostatické príťažlivé sily. Naopak, pri priblížení k atómu by sa zdalo, že elektrón by sa mal odpudzovať od rovnakých záporne nabitých elektrónov, ktoré tvoria elektrónový obal. To v skutočnosti nie je pravda. Pamätajte, či ste sa niekedy museli vyrovnávať s atómovým chlórom. Samozrejme, že nie. Koniec koncov, existuje iba pri veľmi vysokých teplotách. Ani stabilnejší molekulárny chlór sa v prírode prakticky nenachádza - ak je to potrebné, musí sa získať pomocou chemických reakcií. A s chloridom sodným (kuchynskou soľou) sa musíte neustále vyrovnávať. Koniec koncov, kuchynskú soľ konzumuje každý deň človek s jedlom. A v prírode sa vyskytuje pomerne často. Ale zloženie kuchynskej soli zahŕňa ióny chloridu, to znamená atómy chlóru, ktoré majú pripojený jeden „extra“ elektrón. Jedným z dôvodov tejto prevalencie chloridových iónov je to, že atómy chlóru majú tendenciu viazať elektróny, to znamená, že keď sa z atómov a elektrónov chlóru tvoria chloridové ióny, energia sa uvoľňuje.
Jeden z dôvodov uvoľňovania energie je vám už známy - je spojený so zvýšením symetrie elektrónového obalu atómu chlóru počas prechodu na jednotlivo nabitý anión... Zároveň, ako si pamätáte, energia 3 p-úroveň klesá. Existujú aj ďalšie zložitejšie dôvody.
Vzhľadom na to, že na hodnotu elektrónovej afinitnej energie má vplyv niekoľko faktorov, je povaha zmeny tejto hodnoty v sústave prvkov omnoho zložitejšia ako povaha zmeny ionizačnej energie. Môžete sa o tom presvedčiť analýzou tabuľky uvedenej v prílohe 7. Ale keďže hodnota tejto veličiny je určená predovšetkým rovnakou elektrostatickou interakciou ako hodnoty ionizačnej energie, potom jej zmenou v sústave prvkov (aspoň v A- skupiny) je vo všeobecnosti podobná zmene ionizačnej energie, to znamená, že energia afinity k elektrónu v skupine klesá a v období sa zvyšuje. Je maximálna pre atómy fluóru (328 kJ / mol) a chlóru (349 kJ / mol). Povaha zmeny energie afinity k elektrónu v sústave prvkov sa podobá povahe zmeny ionizačnej energie, to znamená, že smer zvýšenia energie afinity k elektrónu možno schematicky znázorniť takto:
2. Na rovnakej mierke pozdĺž vodorovnej osi ako v predchádzajúcich úlohách vyneste závislosť molárnej energie afinity k elektrónu na radovom čísle pre atómy prvkov s Z od 1 do 40 pomocou aplikácie 7.
3. Aký je fyzikálny význam záporných hodnôt energie elektrónovej afinity?
4. Prečo zo všetkých atómov prvkov 2. periódy iba berýlium, dusík a neón majú záporné hodnoty molárnej energie afinity pre elektrón?
6.15. Tendencia atómov dávať a pripájať elektróny
Už viete, že sklon atómu vzdať sa svojich vlastných a pripájať cudzie elektróny závisí od jeho energetických charakteristík (ionizačná energia a energia elektrónovej afinity). Ktoré atómy sú náchylnejšie darovať svoje elektróny a ktoré viac prijímajú ďalšie?
Aby sme si odpovedali na túto otázku, zhrňme si v tabuľke 15 všetko, čo vieme o zmene týchto tendencií v systéme prvkov.
Tabuľka 15. Zmena sklonu atómov vzdať sa vlastných a pripojiť cudzie elektróny
Prednáška 8. Elektróny v kryštáloch
Kvantová teória elektrickej vodivosti kovov. Fermiho úroveň. Prvky zónovej teórie kryštálov. Fenomén supravodivosti z pohľadu Fermi-Diracovej teórie. Elektrická vodivosť polovodičov. Koncept vodivosti dier. Vlastné a nečisté polovodiče. Koncept spojenia p-n. Vlastná vodivosť polovodičov. Nečistoty polovodiče. Elektromagnetické javy na rozhraní. p-n-križovatka.Fotovodivosť polovodičov. Luminiscencia látky. Termoelektrické javy. Seebeckov fenomén. Peltierov efekt. Thomsonov fenomén.
8.1. Kvantová teória elektrickej vodivosti kovov. Fermiho úroveň. Prvky zónovej teórie kryštálov
Klasická elektronická teória vodivosti kovov poskytuje uspokojivú kvalitatívnu zhodu s experimentom. Vedie to však k významnému nesúladu so skúsenosťami pri vysvetľovaní mnohých dôležitých zákonov a javov, ako napríklad:
a) zákon závislosti elektrického odporu na teplote;
b) zákon Dulong a Petit;
c) zákon závislosti tepelnej kapacity kovov a zliatin od teploty;
d) fenomén supravodivosti.
Takže napríklad podľa klasickej elektronickej teórie vedenia kovov si elektróny voľného vedenia vymieňajú energiu s kryštálovou mriežkou iba pri kolíziách; preto by atómová tepelná kapacita kovu C m mala byť súčtom tepelných kapacít kryštálovej mriežky C mc a tepelnej kapacity elektrónového plynu C me, t.j.
Tepelná kapacita kryštálovej mriežky
 .
(8.2)
.
(8.2)
Pre tepelnú kapacitu elektrónového plynu máme
 .
(8.3)
.
(8.3)
Podľa klasickej elektronickej teórie vodivosti kovov pre atómovú tepelnú kapacitu kovov a zliatin teda máme
 .
(8.4)
.
(8.4)
Podľa zákona Dulonga a Petita sa atómová tepelná kapacita kovov a dielektrík, ktoré nemajú elektróny voľného vedenia, významne nelíši a rovná sa
 .
(8.5)
.
(8.5)
Dulongov a Petitov zákon je potvrdený experimentálne.
Obmedzenie klasickej teórie vodivosti kovov je dôsledkom skutočnosti, že súbor voľných elektrónov považuje za ideálny klasický elektrónový plyn, ktorý je v súlade s určitou funkciou (Boltzmannovo rozdelenie) charakterizujúcou pravdepodobnosť ich výskytu v jednotkovom objeme s určitou energiou a pri danej teplote:
 ,
(8.6)
,
(8.6)
kde W je elektrónová energia;
T je absolútna teplota;
k je Boltzmannova konštanta;
A - koeficient charakterizujúci stav elektrónov ako celku.
Z vzorca (8.6) je zrejmé, že pre T0 a W0 je funkcia  ... To znamená, že celková energia vodivých elektrónov môže nadobúdať akékoľvek hodnoty. Každý elektrón je odlišný od ostatných. Je individuálny. V takom prípade musia byť všetky elektróny na nulovej úrovni a ich neobmedzený počet môže byť v každom stave s danou energiou. To je v rozpore s experimentálnymi údajmi. Distribučná funkcia (8.6) preto nie je vhodná na opis stavu elektrónov v tuhých látkach.
... To znamená, že celková energia vodivých elektrónov môže nadobúdať akékoľvek hodnoty. Každý elektrón je odlišný od ostatných. Je individuálny. V takom prípade musia byť všetky elektróny na nulovej úrovni a ich neobmedzený počet môže byť v každom stave s danou energiou. To je v rozpore s experimentálnymi údajmi. Distribučná funkcia (8.6) preto nie je vhodná na opis stavu elektrónov v tuhých látkach.
Nemecký fyzik Sommerfeld a sovietsky teoretický fyzik Ya I. Frenkel navrhli na popísanie stavu elektrónov v kovoch použiť Pauliho princíp, ktorý bol formulovaný skôr pre elektróny v atómoch. V kovu, ako v každom kvantovom systéme, na každej energetickej úrovni nemôžu byť viac ako dva elektróny s opačnými otáčkami - mechanickými a magnetickými momentmi.
Popis pohybu elektrónov voľného vedenia v kvantovej teórii je uskutočňovaný Fermi-Diracovou štatistikou, ktorá zohľadňuje ich kvantové vlastnosti a vlastnosti korpuskulárnych vĺn.
Podľa tejto teórie môže hybnosť (hybnosť) a energia vodivých elektrónov v kovoch nadobúdať iba diskrétnu sériu hodnôt. Inými slovami, existujú určité diskrétne hodnoty rýchlosti elektrónov a úrovní energie.
E  tieto diskrétne hodnoty tvoria takzvané povolené zóny, sú od seba navzájom oddelené zakázanými zónami (obr. 8.1). Na obrázku sú priame vodorovné čiary energetické úrovne;
tieto diskrétne hodnoty tvoria takzvané povolené zóny, sú od seba navzájom oddelené zakázanými zónami (obr. 8.1). Na obrázku sú priame vodorovné čiary energetické úrovne;  - šírka zakázanej zóny; A, B, C - povolené zóny.
- šírka zakázanej zóny; A, B, C - povolené zóny.
Pauliho princíp je v tomto prípade implementovaný takto: na každej energetickej úrovni nemôžu byť viac ako 2 elektróny s opačnými otáčkami.
Plnenie energetických hladín elektrónmi nie je náhodné, ale riadi sa Fermiho-Diracovým rozdelením. Distribúcia je určená hustotou pravdepodobnosti úrovne populácie  :
:

 (8.7),
(8.7),
kde  - funkcia Fermi-Dirac;
- funkcia Fermi-Dirac;
W F - Fermiho úroveň.
Úroveň Fermi je najvyššia osídlená úroveň pri T \u003d 0.
Graficky možno funkciu Fermi-Dirac znázorniť tak, ako je to znázornené na obr. 8.2.
Hodnota Fermiho hladiny závisí od typu kryštálovej mriežky a chemického zloženia. Ak  , potom sa naplnia úrovne zodpovedajúce danej energii. Ak
, potom sa naplnia úrovne zodpovedajúce danej energii. Ak  , potom sú úrovne zadarmo. Ak
, potom sú úrovne zadarmo. Ak  , potom môžu byť tieto úrovne bezplatné aj osídlené.
, potom môžu byť tieto úrovne bezplatné aj osídlené.
Kedy  funkcia Fermi-Dirac sa stáva diskontinuálnou funkciou a krivkou
funkcia Fermi-Dirac sa stáva diskontinuálnou funkciou a krivkou  - krok. Viac
- krok. Viac  , miernejší sklon krivky
, miernejší sklon krivky  ... Avšak pri skutočných teplotách je oblasť rozmazania funkcie Fermi-Dirac niekoľko kT.
... Avšak pri skutočných teplotách je oblasť rozmazania funkcie Fermi-Dirac niekoľko kT.
P  pri teplote
pri teplote  , Ak
, Ak  potom
potom  , čo znamená, že všetky úrovne s takými energiami sú obsadené. Ak
, čo znamená, že všetky úrovne s takými energiami sú obsadené. Ak  potom
potom  , t.j. všetky vyššie úrovne sú neobsadené (Obrázok 8.3).
, t.j. všetky vyššie úrovne sú neobsadené (Obrázok 8.3).
Hladina Fermiho výrazne prevyšuje energiu tepelného pohybu, t.j. W F \u003e\u003e kT. Veľká hodnota energie elektrónového plynu v kovoch je spôsobená Pauliho princípom, t.j. je netermického pôvodu. Nemožno ju odobrať znížením teploty.
Kedy  funkcia Fermi-Dirac sa stáva nepretržitou. Ak
funkcia Fermi-Dirac sa stáva nepretržitou. Ak  o niekoľko kT možno jednotku v menovateli zanedbať a potom
o niekoľko kT možno jednotku v menovateli zanedbať a potom
Distribúcia Fermi-Dirac sa tak stáva Boltzmannovou distribúciou.
V kovoch pri T0 K funkcia f (W) v prvej aproximácii prakticky nemení svoju hodnotu.
Stupeň naplnenia energetických hladín v pásme elektrónmi je určený naplnením príslušnej atómovej hladiny. Napríklad, ak je nejaká hladina atómu úplne naplnená elektrónmi v súlade s Pauliho princípom, potom je z nej vytvorená aj zóna úplne vyplnená. V tomto prípade môžeme hovoriť o valenčnom pásme, ktoré je úplne naplnené elektrónmi a je tvorené z energetických hladín vnútorných elektrónov voľných atómov, a o vodivom pásme (voľné pásmo), ktoré je buď čiastočne naplnené elektrónmi, alebo voľné a tvorené z energetických hladín vonkajších „kolektivizovaných“ elektrónov. izolované atómy (obr. 8.4).
IN 
 v závislosti od stupňa naplnenia pásov elektrónmi a medzery medzi pásmami sú možné nasledujúce prípady. Na obrázku 8.5 je najhornejšia oblasť obsahujúca elektróny vyplnená iba čiastočne; má voľné úrovne. V tomto prípade môže elektrón, ktorý dostal ľubovoľne malú energiu (napríklad v dôsledku tepelného pôsobenia alebo pôsobenia elektrického poľa), ísť na vyššiu energetickú hladinu tej istej zóny, t.j. osloboďte sa a podieľajte sa na vedení. Prechod intrazónu je celkom možný v prípade, keď je energia tepelného pohybu oveľa väčšia ako rozdiel v energiách medzi susednými úrovňami zóny. Ak teda v tuhej látke existuje zóna čiastočne naplnená elektrónmi, potom bude toto teleso vždy vodičom elektrického prúdu. To je typické pre kovy a ich zliatiny.
v závislosti od stupňa naplnenia pásov elektrónmi a medzery medzi pásmami sú možné nasledujúce prípady. Na obrázku 8.5 je najhornejšia oblasť obsahujúca elektróny vyplnená iba čiastočne; má voľné úrovne. V tomto prípade môže elektrón, ktorý dostal ľubovoľne malú energiu (napríklad v dôsledku tepelného pôsobenia alebo pôsobenia elektrického poľa), ísť na vyššiu energetickú hladinu tej istej zóny, t.j. osloboďte sa a podieľajte sa na vedení. Prechod intrazónu je celkom možný v prípade, keď je energia tepelného pohybu oveľa väčšia ako rozdiel v energiách medzi susednými úrovňami zóny. Ak teda v tuhej látke existuje zóna čiastočne naplnená elektrónmi, potom bude toto teleso vždy vodičom elektrického prúdu. To je typické pre kovy a ich zliatiny.
P  tuhou látkou môže byť aj vodič elektrického prúdu v prípade, keď sa valenčné pásmo prekrýva voľným pásmom. Objaví sa neúplne naplnená zóna (obr. 8.6), ktorá sa niekedy nazýva „hybridná“. „Hybridné“ pásmo je len čiastočne vyplnené valenčnými elektrónmi. Prekrytie zón sa pozoruje u prvkov alkalických zemín.
tuhou látkou môže byť aj vodič elektrického prúdu v prípade, keď sa valenčné pásmo prekrýva voľným pásmom. Objaví sa neúplne naplnená zóna (obr. 8.6), ktorá sa niekedy nazýva „hybridná“. „Hybridné“ pásmo je len čiastočne vyplnené valenčnými elektrónmi. Prekrytie zón sa pozoruje u prvkov alkalických zemín.
Z hľadiska Fermi-Diracovej teórie dochádza k plneniu pásiem elektrónmi nasledovne. Ak je energia elektrónov W\u003e W F, potom pri T \u003d 0 je distribučná funkcia f (W) \u003d 0, čo znamená, že na úrovniach nachádzajúcich sa za Fermiho úrovňou nie sú žiadne elektróny.
Ak energia elektrónov W Pri T0 sa tepelná energia kT prenáša na elektróny, a preto môžu elektróny z nižších úrovní ísť na úroveň nad úrovňou Fermiho. Dochádza k tepelnej excitácii vodivých elektrónov. IN K zvýšeniu energie vodivých elektrónov môže dôjsť nielen v dôsledku „tepelného“ javu, ale aj v dôsledku pôsobenia elektrického poľa (potenciálny rozdiel), v dôsledku čoho získajú usporiadaný pohyb. Ak je pásmová medzera kryštálu rádovo niekoľko elektrónvoltov, potom tepelný pohyb nemôže prenášať elektróny z valenčného pásma do vodivého pásma a kryštál je dielektrikum, pri ktorom zostáva pri všetkých skutočných teplotách. Ak je medzera v kryštalickom páse rádovo 1 eV, t.j. skôr úzky, potom je možný prechod elektrónov z valenčného pásma do vodivého pásma. Môže sa to uskutočniť buď tepelným budením, alebo objavením sa elektrického poľa. V tomto prípade je tuhou látkou polovodič. Rozdiel medzi kovmi a dielektrikami je z pohľadu teórie pásma v tom, že pri 0 K sú elektróny vo vodivom pásme kovov, ale nie sú vo vodivom pásme dielektrika. Rozdiel medzi dielektrikami a polovodičmi určuje medzera v pásme: pre dielektriká je dosť široká (napríklad pre NaCl ,W \u003d 6 eV), pre polovodiče skôr úzka (pre germánium W \u003d 0,72 eV). Pri teplotách blízkych 0 K sa polovodiče správajú ako dielektrika, pretože nedochádza k prechodu elektrónov do vodivého pásma. So zvyšovaním teploty v polovodičoch sa zvyšuje počet elektrónov, ktoré v dôsledku tepelného budenia prechádzajú do vodivého pásma, t.j. elektrická vodivosť polovodičov sa v tomto prípade zvyšuje. V kvantovej teórii sa vodivé elektróny považujú za častice s vlnovými vlastnosťami a ich pohyb v kovoch sa považuje za proces šírenia elektrónových vĺn, ktorého dĺžka je určená de Broglieho vzťahom: kde h je Planckova konštanta; p je hybnosť elektrónu. V dokonalom kryštáli, v ktorého uzloch kryštálovej mriežky sú stacionárne častice (ióny), vodivé elektróny (elektrónové vlny) nezažívajú interakcie (rozptyl), a taký kryštál, a teda kov, neponúka odolnosť voči prechodu elektrického prúdu. Vodivosť takéhoto kryštálu má sklon k nekonečnu a elektrický odpor k nule. V skutočných kryštáloch (kovy a zliatiny) existujú rôzne centrá nehomogenity (skreslenia) rozptyľujúce elektróny, ktoré majú väčšiu veľkosť ako dĺžka elektrónových vĺn. Takýmito stredmi sú fluktuácie hustoty mriežkového skreslenia vznikajúce v dôsledku tepelného pohybu (tepelné vibrácie) jeho uzlov; rôzne štrukturálne chyby, intersticiálne a substitučné atómy, atómy nečistoty a iné. Pri náhodnom pohybe elektrónov sa medzi uzlami kryštálovej mriežky nachádzajú také, ktoré sa momentálne pohybujú smerom k sebe. Ukázalo sa, že vzdialenosť medzi nimi je v tomto okamihu menšia ako ich vzdialenosť v pevnej mriežke. To vedie k zvýšeniu hustoty látky v mikrobubline obsahujúcej tieto atómy (nad priemernú hustotu látky). V susedných regiónoch vznikajú mikrosvaly, v ktorých je hustota látky nižšia ako jej priemerná hodnota. Tieto odchýlky hustoty látky od priemernej hodnoty predstavujú kolísanie hustoty. Výsledkom je, že v danom okamihu je kov (tuhý) mikroskopicky nehomogénny. Táto nehomogenita je tým významnejšia, čím menšie sú mikrovolumy (čím menej atómov uzlov mikrovolupy pokrývajú). Veľkosť takýchto mikroobjemov je spravidla väčšia ako dĺžka elektrónových vĺn, v dôsledku čoho sú účinnými centrami rozptylu týchto vĺn. Tok voľných elektrónov v kove podlieha rovnakému rozptylu ako svetelné vlny na suspendovaných časticiach zakaleného média. To je dôvod elektrického odporu absolútne čistých kovov. Rozptylová sila kovov v dôsledku kolísania hustoty je charakterizovaná rozptylovým koeficientom T. Pre voľné elektróny koeficient rozptylu kde<> Je stredná voľná dráha elektrónu. Hodnota koeficientu rozptylu prostredníctvom charakteristík tepelného pohybu uzlov kryštálovej mriežky a jej elastických konštánt sa ukáže byť: kde n je počet atómov (uzlov) na jednotku objemu (v 1 m 3); E je modul pružnosti; d je mriežkový parameter; T je absolútna teplota; k je Boltzmannova konštanta. Teda Ak vezmeme do úvahy rovnicu (8.12), špecifickú elektrickú vodivosť kovu Z výrazu (8.13) je zrejmé, že špecifická elektrická vodivosť kovov je nepriamo úmerná absolútnej teplote. V dôsledku toho by mal byť odpor kovov priamo úmerný absolútnej teplote, čo je v dobrom súlade s experimentom. Expresiu (8,17) získal Sommerfeld na základe kvantovej teórie Fermi-Dirac. Rozdiel výrazu (8.13) od vzorca Tepelné vibrácie miest kryštálovej mriežky nie sú jedinými zdrojmi skreslenia vedúceho k rozptylu elektrónových vĺn. Rovnakými zdrojmi sú všetky druhy štrukturálnych deformácií (chýb): nečistoty, deformácie atď. Preto sa koeficient rozptylu skladá z dvoch častí: kde T je koeficient tepelného rozptylu; st \u003d pr + d - koeficient rozptylu v dôsledku štrukturálnych deformácií; pr - koeficient rozptylu v dôsledku nečistôt; d - koeficient rozptylu v dôsledku deformácie. Pri príliš nízkych teplotách T T (pri nízkych teplotách T T 5) nedochádza k deformáciám
sv je úmerná koncentrácii nečistôt a nezávisí od teploty, preto Potom možno určiť elektrický odpor takto: Pri T0, T 0 a st na takzvaný zvyškový odpor, ktorý nezmizne pri teplote rovnajúcej sa absolútnej nule. Pretože počet vodivých elektrónov v kovu nezávisí od teploty, charakteristika prúdového napätia kovového vodiča má formu priamky. Aktualizácia 27. 10. 2017 [POZNÁMKA. Moja predchádzajúca nezmenená odpoveď zameraná na notáciu je pod touto aktualizáciou.] Áno. Aj keď prítomnosť oktetu valenčných elektrónov vytvára pre väčšinu atómov extrémne hlboké energetické minimum, je to iba minimum, nie zásadná požiadavka. Ak existujú dostatočne silné kompenzačné energetické faktory, potom aj atómy, ktoré silne uprednostňujú oktety, môžu vytvárať stabilné zlúčeniny s viac (alebo menej) ako 8 elektrónových valenčných škrupín. Rovnaké väzbové mechanizmy, ktoré umožňujú vytvorenie viac ako 8 valenčných škrupín, však poskytujú aj alternatívne štrukturálne interpretácie takýchto škrupín, hlavne v závislosti od toho, či sú tieto väzby interpretované ako iónové alebo kovalentné. Vynikajúca odpoveď Manishera skúma túto otázku oveľa podrobnejšie ako tu. Hexafluorid sírový, $ \\ ce (SF6) $, je nádherným príkladom tejto nejednoznačnosti. Ako som schematicky opísal vo svojej pôvodnej odpovedi, centrálny atóm síry v $ \\ ce (SF6) $ možno interpretovať ako: a) atóm síry, v ktorom je všetkých 6 jeho valenčných elektrónov úplne ionizovaných šiestimi atómami fluóru, alebo b) atóm síry so stabilným vysoko symetrickým 12-elektrónovým valenčným plášťom, ktorý je tvorený a stabilizovaný šiestimi oktaedrickými atómami fluóru, z ktorých každý kovalentne zdieľa elektrónový pár s centrálnym atómom síry. Aj keď sú obidve tieto interpretácie vierohodné z čisto štrukturálneho hľadiska, interpretácia ionizácie má vážne problémy. Prvým a najväčším problémom je, že na úplnú ionizáciu všetkých 6 valenčných elektrónov síry by boli potrebné nereálne energetické hladiny (lepšie by mohlo byť slovo „astronomické“). Druhá otázka je, že stabilita a čistá oktaedrická symetria $ \\ ce (SF6) $ silne naznačujú, že 12 elektrónov okolo atómu síry dosiahlo stabilné a dobre definované energetické minimum, odlišné od svojej obvyklej oktetovej štruktúry. Obe bodky znamenajú, že jednoduchšia a energeticky presnejšia interpretácia valenčného obalu síry v $ \\ ce (SF6) $ spočíva v tom, že má 12 elektrónov v stabilnej konfigurácii, ktorá nie je oktetová. Tiež si všimneme, že pre síru táto 12-elektrónová stabilná minimálna energia nie je spojená s veľkým počtom valenčne viazaných elektrónov pozorovaných v obaloch prechodových prvkov, pretože síra jednoducho nemá dostatok elektrónov na prístup k zložitejším orbitálom. Dvanásťvalenčný elektrónový obal $ \\ ce (SF6) $ je namiesto toho skutočným ohybom pravidiel pre atóm, ktorý takmer vo všetkých ostatných prípadoch uprednostňuje oktet valenčných elektrónov. Preto je moja všeobecná odpoveď na túto otázku jednoducho áno. Otázka: Prečo špeciálne oktety? Odvrátená strana existencie stabilných neokinetických valenčných škrupín je táto: prečo oktetové mušle poskytujú minimálne energetické minimum, také hlboké a univerzálne, že celá periodická tabuľka je štruktúrovaná do čiar, ktoré končia (s výnimkou hélia) vzácnymi plynmi s oktetovým valenčným plášťom? Stručne povedané, dôvodom je, že pre každú energetickú hladinu nad konkrétnym prípadom škrupiny $ n \u003d 1 $ (hélium) je orbitálna množina „uzavretej škrupiny“ $ \\ (s, p_x, p_y, p_z \\) $ iba kombináciou orbitálov, uhlových ktorých momenty (a) sú navzájom vzájomne kolmé a (b) zahŕňajú všetky také ortogonálne možnosti trojrozmerného priestoru. Práve toto jedinečné ortogonálne rozdelenie možností momentu hybnosti v trojrozmernom priestore robí oktet orbitálov $ \\ (s, p_x, p_y, p_z \\) $ obzvlášť hlbokým a relevantným aj v škrupinách s najvyššou energiou. Vidíme o tom fyzikálne dôkazy v úžasnej stabilite vzácnych plynov. Dôvodom, prečo je ortogonálnosť stavov momentu hybnosti v atómovom meradle taká dôležitá, je Pauliho vylučovací princíp, ktorý vyžaduje, aby každý elektrón mal svoj vlastný jedinečný stav. Prítomnosť stavov ortogonálneho momentu hybnosti poskytuje obzvlášť čistý a jednoduchý spôsob, ako zabezpečiť silné oddelenie stavov medzi elektrónovými orbitálmi a vyhnúť sa tak veľkým trestom uloženým Pauliho vylúčením. Pauliho vylúčenie naopak neúplne ortogonálne sady orbitálov energeticky oveľa menej zatraktívni. Pretože nútia viac orbitálov zdieľať rovnaké sférické priestory ako ortogonálne orbitály $ p_x $, $ p_y $ a $ p_d $ oktetu, orbitály $ d $, $ f $ a vyššie sa stávajú menej ortogonálnymi, a teda podliehajú zvýšeným pokutám s výnimkou Pauliho. Posledná poznámka Neskôr môžem pridať ďalší doplnok na vysvetlenie ortogonality momentu hybnosti v zmysle klasických kruhových satelitných dráh. Ak tak urobím, pridám aj malé vysvetlenie toho, prečo majú obežné dráhy $ p $ také neobvykle odlišné tvary činiek. (Tip: Ak ste niekedy sledovali, ako ľudia vytvárajú dve slučky v jednom švihadle, rovnice za týmito dvojitými slučkami majú neočakávanú podobnosť s rovnicami za $ p $ orbitalmi.) Pôvodná odpoveď 2014-ish (nezmenené) Cieľom tejto odpovede je skôr doplniť skoršiu odpoveď Manishera, než s ňou súťažiť. Mojím cieľom je ukázať, ako môžu byť oktetové pravidlá užitočné aj pre molekuly, ktoré vo svojej valenčnej škrupine obsahujú viac ako obvyklý doplnok ôsmich elektrónov. Nazývam to darom a týka sa mojich školských čias, keď sa žiadny z textov o chémii v mojej knižnici v malom meste neobťažoval vysvetliť, ako tieto kyslíkové väzby fungujú v aniónoch, ako sú uhličitany, chlorečnany, sírany, dusičnany a fosfáty. Myšlienka týchto označení je jednoduchá. Začínate poznámkou s elektronickými bodkami a potom pridajte šípky, ktoré ukazujú, ako a ako si iné atómy „požičiavajú“ jednotlivé elektróny. Bodka so šípkou znamená, že elektrón „patrí“ primárne atómu v spodnej časti šípky, ale iný atóm ho používa na vyplnenie oktetu atómu. Jednoduchá šípka bez bodky naznačuje, že elektrón skutočne opustil pôvodný atóm. V tomto prípade elektrón už nie je pripojený k šípke, ale zobrazuje sa ako nárast počtu valenčných elektrónov v atómoch na konci šípky. Tu sú príklady použitia kuchynskej soli (iónovej) a kyslíka (kovalentné): Všimnite si, že iónová väzba $ \\ ce (NaCl) $ sa javí jednoducho ako šípka, čo naznačuje, že „darovala“ svoj vonkajší elektrón a klesla späť do svojho vnútorného elektrónového oktetu, aby uspokojila svoje vlastné terminačné priority. (Takéto interné oktety sa nikdy nezobrazia.) Kovalentné väzby sa vyskytujú, keď každý atóm prispieva do väzby jedným elektrónom. Oba elektróny sú zobrazené v daroch, takže dvojnásobne viazaný kyslík končí štyrmi šípkami medzi atómami. Pre jednoduché kovalentné väzby však nie je potrebný notačný zápis. Má skôr ukázať, ako väzba funguje v aniónoch. Dvomi príbuznými príkladmi sú síran vápenatý ($ \\ ce (CaSO4) $, známejší ako sadra) a siričitan vápenatý ($ \\ ce (CaSO3) $, bežný konzervant potravín): V týchto príkladoch vápnik obetuje hlavne iónovú väzbu, takže jeho prínosom je dvojica šípok, ktoré prenášajú dva elektróny do jadra aniónu a plnia oktet atómu síry. Potom sa atómy kyslíka viažu na síru a „požičiavajú“ si celé páry elektrónov bez toho, aby k čomukoľvek prispievali. Tento typ výpožičky je hlavným faktorom, prečo môže existovať viac ako jeden anión pre prvky, ako je síra (sírany a siričitany) a dusík (dusičnany a dusitany). Pretože atómy kyslíka nie sú potrebné na to, aby centrálny atóm vytvoril plný oktet, niektoré páry v centrálnom oktete môžu zostať nepripojené. To vedie k menej oxidovaným aniónom, ako sú siričitany a dusitany. A nakoniec nejednoznačným príkladom je hexafluorid sírový: Obrázok ukazuje dve možnosti. Ak je $ \\ ce (SF6) $ modelované tak, akoby síra bola kovom, ktorý daroval všetky svoje elektróny hyperagresívnym atómom fluóru (možnosť a), alebo ak je pravidlo oktetu nižšie ako slabšie, ale stále realizovateľné pravidlo 12 elektrónov (možnosť b)? O tom, ako by sa s takýmito prípadmi malo zaobchádzať, sa vedú kontroverzie aj dnes. Obetavý zápis ukazuje, ako je možné v takýchto prípadoch použiť oktetovú perspektívu, aj keď sa nikdy neodporúča spoliehať sa na aproximačné modely prvého rádu pre takéto okrajové prípady. Aktualizácia 04.04.2014 Nakoniec, ak vás už unavujú bodky a šípky a túžite po niečom bližšie k štandardnému zápisu valenčných väzieb, prídu vhod tieto dve ekvivalencie: Ekvivalencia hornej priamky je triviálna, pretože výsledná čiara má rovnaký vzhľad a označuje štandardnú kovalentnú väzbu v organickej chémii. Druhá notácia u-bond je nový. Prišiel som s tým z frustrácie na strednej škole ešte v 70. rokoch (áno, som taký starý), ale vtedy som neurobil nič. Hlavnou výhodou zápisu u-väzby je, že umožňuje prototypovanie a vyhodnotenie neštandardných väzieb iba pomocou štandardných atómových valencií. Rovnako ako priama kovalentná väzba, čiara tvoriaca u-väzbu je jeden pár elektrónov. Avšak v u-väzbe je to atóm na dne U, ktorý daruje oboje elektróny v páre. Tento atóm nezíska nič z transakcie, takže sa nijaké z jeho problémov so väzbou nezmení ani nevyhovie. Túto nevýhodu pri ukončení predstavuje absencia akýchkoľvek koncov liniek na tejto strane u-väzby. Atóm žobráka na vrchole U sa dostane zadarmo oboje elektróny, čo to zase znamená dva jeho valenčné väzby sú splnené. To sa primerane odráža v skutočnosti, že obidva konce línie U sú blízko tohto atómu. Ako celok, atóm na dne u-väzby hovorí: „Toto sa mi nepáči, ale ak ty , čo zúfalo túžim po páre elektrónov, a ak sľúbiš, že zostaneš veľmi blízko, dovolím ti zacvaknúť pár elektrónov z môjho už dokončeného okteta. “ Oxid uhoľnatý so zmäteným „prečo má uhlík zrazu valenciu dva?“ štruktúra dobre ilustruje, ako u-dlhopisy interpretujú také dlhopisy v zmysle tradičnejších dlhopisov: Všimnite si, že dve zo štyroch uhlíkových väzieb sú rozlíšené štandardnými kovalentnými väzbami s kyslíkom a zvyšné dve uhlíkové väzby sú rozlíšené vytvorením väzby u, ktorá umožňuje žobravému uhlíku „zdieľať“ s jedným z elektrónových párov z už kyslíkom naplneného okteta. Uhlík končí na štyroch líniových koncoch, čo predstavuje jeho štyri väzby, a kyslík na dvoch. Oba atómy majú teda svoje vlastné štandardné čísla väzieb. Ďalším jemnejším chápaním tohto obrázku je, že keďže u-väzba je jeden pár elektrónov, kombinácia jednej u-väzby a dvoch tradičných kovalentných väzieb medzi atómami uhlíka a kyslíka obsahuje celkom šesť elektrónov, a preto musí mať podobnosť so šesť elektrónovou trojitou väzbou medzi dvoma atómami dusíka. Táto malá predpoveď sa ukazuje ako správna: molekuly oxidu dusnatého a oxidu uhoľnatého sú vlastne homológmi elektrónovej konfigurácie, čoho dôsledkom je, že majú takmer rovnaké fyzikálne chemické vlastnosti. Ďalej uvádzame niekoľko ďalších príkladov toho, ako môže notácia u-väzby spôsobiť, že anióny, zlúčeniny vzácnych plynov a zvláštne organické zlúčeniny pôsobia trochu menej tajomne: Áno, môže. Máme molekuly, ktoré obsahujú „super oktetové atómy“. Príklady: $ \\ ce (PBr5, XeF6, SF6, HClO4, Cl2O7, I3-, K4, O \u003d PPh3) $ Takmer koordinačné zlúčeniny všetko mať ústredný prvok nadvýberu. K tomu sú náchylné aj nekovy od 3. obdobia a ďalej. Opakovanými priestupkami sú halogény, síra a fosfor a všetko zlúčeniny vzácneho plynu sú superoctetes. Síra teda môže mať valenciu +6, fosfor +5 a halogény +1, +3, +5 a +7. Upozorňujeme, že stále ide o kovalentné väzby - význam platí aj pre kovalentné väzby. Dôvod, ktorý sa zvyčajne nedodržiava, je nasledovný. V zásade to odvodzujeme od vlastností atómových orbitálov. Všimnite si, že existuje niekoľko nezrovnalostí: $ \\ ce (Cu) $, $ \\ ce (Cr) $, $ \\ ce (Ag) $ a kopa ďalších, ktoré som v tabuľke konkrétne neoznačil. V chémii a všeobecne vo vede existuje mnoho spôsobov, ako vysvetliť rovnaké pravidlo. Tu uvádzam prehľad, ktorý je v kvantovej chémii veľmi jednoduchý: mal by byť na počiatočnej úrovni celkom dobre čitateľný, ale v najhlbšom zmysle nevysvetlí dôvody existencie elektrónových obalov. „Pravidlo“, ktoré citujete, je známe ako oktetové pravidlo a jedna z jeho formulácií je nasledovná: atómy nízkych ( Z < 20) atomic number tend to combine
in such a way that they each have eight electrons in their valence
shells Všimnete si, že nejde o valenciu maximálna (t.j. počet elektrónov vo valenčnom plášti) a a preferovaná valencia v molekulách. Bežne sa používa na stanovenie štruktúry Lewisových molekúl. Pravidlo oktetu však nie je koniec príbehu. Ak sa pozriete na vodík (H) a hélium (He), uvidíte, že nepreferujú osem-elektrónovú valenciu, ale dvojelektrónovú: napríklad H. H 2, HF, H 2 O, He (ktorý už má dva elektróny a netvorí molekuly). To sa nazýva duetove pravidlo ... Ťažšie prvky, vrátane všetkých prechodných kovov, navyše nasledujú príznačne pomenované 18-elektrónové pravidlo keď tvoria kovové komplexy. Je to spôsobené kvantovou povahou atómov, kde sú elektróny usporiadané v škrupinách: prvý (nazývaný K obal) má 2 elektróny, druhý (L-obal) má 8, tretí (M-obal) má 18. Atómy sa spájajú do molekúl, ktoré sa vo väčšine prípadov snažia majú valenčné elektróny, ktoré úplne vyplňujú škrupinu. Nakoniec existujú prvky, ktoré v niektorých chemických zlúčeninách porušujú duetové / oktetové / 18-elektrónové pravidlá. Hlavnou výnimkou je rodina hypervalentné molekuly , v ktorom má prvok hlavnej skupiny nominálne viac ako 8 elektrónov vo svojej valenčnej škrupine. Fosfor a síra sú najčastejšie náchylné na tvorbu hypervalentných molekúl vrátane $ \\ ce (PCl5) $, $ \\ ce (SF6) $, $ \\ ce (PO4 ^ 3 -) $, $ \\ ce (SO4 ^ 2 -) $ a atď. Medzi ďalšie prvky, ktoré sa môžu správať týmto spôsobom, patria napríklad jód (v $ \\ ce (IF7) $), xenón (v $ \\ ce (XeF4) $) a chlór (v $ \\ ce (ClF5) $) ... (Tento zoznam nie je vyčerpávajúci.) V roku 1990 publikoval Magnusson zásadné dielo, ktoré konečne vylučuje úlohu d-orbitálnej hybridizácie pri väzbe prvkov druhého radu v hypervalentných zlúčeninách. ( J. Am. Chem. Soc. 1990,
112
(22), 7940-7951. DOI: 10.1021 / ja00178a014.) Keď sa skutočne pozriete na čísla, energia spojená s týmito orbitalmi je významne vyššia ako väzbová energia nájdená experimentálne v molekulách ako $ \\ ce (SF6) $, čo znamená, že je veľmi nepravdepodobné, že by sa d orbitaly vôbec zúčastňovali na tento typ molekulárnej štruktúry. Takto nám zostáva fakticky oktet. Pretože $ \\ ce (S) $ sa nemôže dostať na svoje d-orbitaly, nemôže mať vo svojej valencii viac ako 8 elektrónov (definície valencie atď. Nájdete v ďalších diskusiách na tejto stránke, ale iba v základnej definícii. áno, iba 8). Bežným vysvetlením je myšlienka 3-centrovanej 4-elektrónovej väzby, čo je v podstate myšlienka, že síra a dva fluóry o 180 stupňov zdieľajú medzi svojimi molekulovými orbitalmi iba 4 elektróny. Jedným zo spôsobov, ako to pochopiť, je zvážiť dvojicu rezonančných štruktúr, kde je síra kovalentne viazaná na jeden $ \\ ce (F) $ a iontovo na druhý: $$ \\ ce (F ^ (-) \\ bond (...) ^ (+) S-F<-> F-S + \\ bond (...) F -) $$ Keď spriemerujete tieto dve štruktúry, všimnete si, že síra si zachováva kladný náboj a každý fluorid má akýsi „polovičný“ náboj. Upozorňujeme tiež, že obe štruktúry majú iba dva elektróny , čo znamená, že sa úspešne viaže s dvoma fluórmi, ale akumuluje sa iba dva elektróny. Dôvod, prečo musia byť od seba vzdialené 180 stupňov, je spôsobený geometriou molekulárnych orbitálov, ktorá presahuje rámec tejto odpovede. Pre lepšiu kontrolu sme teda uviazali dva fluóry na síru, ktorá na síre uchováva dva elektróny a 1 kladný náboj. Keby sme zvyšné štyri fluoridy z $ \\ ce (SF6) $ naviazali normálnym kovalentným spôsobom, stále by sme skončili s 10 elektrónmi okolo síry. Použitím ďalšej dvojice elektronických väzieb 3-stred-4 sa teda dostaneme k 8 elektrónom (vyplňujúcim orbitály s aj p-valencie), ako aj náboj $ + 2 $ za síru a náboj $ -2 $ distribuovaný okolo štyri fluóry zapojené do väzby 3c4e. (Samozrejme, všetky fluoridy musia byť ekvivalentné, aby sa náboj skutočne distribuoval cez všetky fluóry, ak vezmeme do úvahy všetky rezonančné štruktúry). V skutočnosti existuje veľa dôkazov na podporu tohto štýlu väzby, najjednoduchšie z nich sa pozorujú pri pohľade na dĺžky väzieb v molekulách, ako je $ \\ ce (ClF3) $ (geometria v tvare T), kde sú dva fluóry od seba vzdialené 180 stupňov. majú navzájom o niečo dlhšiu dĺžku väzby s chlórom ako iné fluoridy, čo naznačuje oslabené množstvo kovalencie v týchto dvoch väzbách $ \\ ce (Cl-F) $ (výsledok spriemerovania kovalentných a iónových väzieb). Ak vás zaujímajú podrobnosti o zapojených molekulárnych orbitáloch, môžete si prečítať túto odpoveď. TL; DR Hypervalencia v skutočnosti neexistuje a mať viac ako $ \\ ce (8 e -) $ v neprechodných kovoch je oveľa ťažšie, ako si myslíte. Na túto otázku môže byť ťažké odpovedať, pretože existuje niekoľko definícií valenčných elektrónov. Niektoré knihy a slovníky definujú valenčné elektróny ako „elektróny vonkajšieho obalu, ktoré sa podieľajú na chemickej väzbe“, a podľa tejto definície môžu prvky obsahovať viac ako 8 valenčných elektrónov, čo je vysvetlené skratkou F „x“. Niekoľko kníh a slovníkov definuje valenčné elektróny ako „elektróny na najvyššej hlavnej energetickej úrovni“. Podľa tejto definície by prvok mal iba 8 valenčných elektrónov, pretože orbitály $ n-1 $ $ d $ sú vyplnené po orbitáloch $ n $ $ s $ a potom sú naplnené orbitálmi $ n $ $ p $. Najvyššia základná energetická úroveň $ n $ teda obsahuje valenčné elektróny. Podľa tejto definície majú prechodné kovy buď 1 alebo 2 valenčné elektróny (v závislosti od toho, koľko elektrónov je na orbitáloch $ s $ a $ d $). Podľa inej definície môžu mať viac, pretože majú viac elektrónov „vonkajšej škrupiny“ (pred naplnením škrupiny $ d $). Použitím definície „najvyššej úrovne základnej energie“ pre valenčné elektróny môžete správne predpovedať paramagnetické správanie iónov prechodných kovov, pretože valenčné elektróny ($ d $ elektróny) sa stratia najskôr, keď prechodný kov vytvorí ión. Medzi „pravidlom“ a prírodným zákonom je veľký rozdiel. „Oktetové pravidlo“ je pojem z konca storočia, ktorý sa nejako dostal do úvodných kníh o chémii a nikdy neprišiel s príchodom modernej kvantovej mechaniky. (Dôkaz: nie je možné identifikovať jednotlivé elektróny na označenie ich „valencie“ alebo „nevalencie“). Preto nenájdete odpoveď na základe fyzických dôkazov, prečo / prečo nebude prijaté pravidlo založené na fyzických dôkazoch. Atómy zaberajú svoju priestorovú konfiguráciu preto, lebo sa ukazuje, že ide o elektrostaticky priaznivú okolnosť, a nie preto, že elektróny používajú „sloty“. Prečo 8? neboli vyššie uvedenými odpoveďami skutočne ovplyvnené, a pokiaľ ide o otázku, je treba ich trochu zvážiť. Všeobecne, ale nie vždy, atómy reagujú na vznik úplných kvantových „škrupín“, pričom elektróny interagujú so všetkými svojimi orbitálmi. Základné kvantové číslo ($ n $) definuje maximálne azimutálne kvantové číslo ($ l $) v tom zmysle, že $ l $ môže nadobúdať hodnoty iba medzi $ 0 $ a $ n-1 $. Takže pre prvý riadok $ n \u003d 1 $ a $ l \u003d 0 $. Pre druhý riadok $ n \u003d 2 $, takže $ l \u003d 0,1 $. Pre tretí riadok $ n \u003d 3 $, takže $ l \u003d 0, 1, 2 $. Azimutálne kvantové číslo $ l $ definuje rozsah možných magnetických kvantových čísel ($ m_l $) ležiacich v rozsahu $ -l \\ leq m_l \\ leq + l $. Takže pre prvý riadok $ m_l \u003d 0 $. V druhom riadku, keď $ n \u003d 2 $ a $ l \u003d 1 $, potom $ m_l \u003d -1, 0, 1 $. V treťom riadku $ n \u003d 3 $, $ l \u003d 0, 1, 2 $, $ m_l \u003d -2, -1, 0, 1, 2 $. Nakoniec, spinové kvantové číslo $ m_s $ môže byť buď $ + 1/2 $ alebo $ -1/2 $. Počet elektrónov, ktoré môžu vyplniť každý obal, sa rovná počtu kombinácií kvantových čísel. Za $ n \u003d 2 $ toto $$ \\ begin (pole) (cccc) n & l & m_l & m_s \\\\ \\ hline 2 & 0 & 0 & +1/2 \\\\ 2 & 0 & 0 & -1/2 \\\\ 2 & 1 & + 1 & +1/2 \\\\ 2 & 1 & +1 & -1/2 \\\\ 2 & 1 & 0 & +1/2 \\\\ 2 & 1 & 0 & -1/2 \\\\ 2 & 1 & - 1 & +1/2 \\\\ 2 & 1 & -1 & -1/2 \\\\ \\ end (pole) $$ iba pre 8 elektrónov. Druhý riadok obsahuje „organické zlúčeniny“, ktorých sú známe milióny, a preto sa často vyhýbajú tomu, aby učili chémiu, aby sa zamerali na „pravidlo oktetu“. V skutočnosti existuje duetové pravidlo pre vodík, hélium (a lítium, ktoré dimerizuje v plynnej fáze) a „pravidlo 18“ pre prechodné kovy. To, v čom je „nepríjemné“, je kremík prostredníctvom chlóru. Tieto atómy môžu vytvárať úplnú kvantovú obálku podľa pravidla oktetu alebo „rozširovať“ svoje oktety a riadiť sa podľa pravidla 18. Alebo medzi situáciami, ako je napríklad hexafluorid sírový. Majte na pamäti, že ide o hrubé zjednodušenie, pretože tieto atómové orbitaly sa miešajú s molekulovými orbitalmi, ale počty atómových obežných dráh ovplyvňujú a priamo korelujú s počtom získaných molekulárnych orbitálov, takže kombinácia atómových kvantových čísel stále poskytuje niektoré zaujímavé informácie. Pozrime sa na periodickú tabuľku: v prvom rade sú iba dva prvky: vodík a hélium. Nedodržiavajú pravidlo oktetu. Na valenčnej dráhe môže mať vodík najviac dva elektróny. Ukazuje sa, že oktetové pravidlo nie je výlučné, to znamená, že nie je jediným pravidlom, ktoré pomáha pochopiť Lewisovu štruktúru a elektronickú konfiguráciu. Prečo používame pravidlo oktetu? Každá perióda v periodickej tabuľke predstavuje energetický obal atómu. Prvé obdobie je škrupina K, prvá energetická úroveň, ktorá má iba s-orbitál. Každá obežná dráha môže byť naplnená iba dvoma elektrónmi, ako pri kvantovej rotácii v opačných smeroch. Maximálny možný počet elektrónov pre prvý plášť energetickej úrovne K je teda 2. To sa odráža v skutočnosti, že hélium je vzácny plyn, ale obsahuje iba 2. Druhý plášť energetickej hladiny L má s-orbitál a ďalšie 3 p-orbitály. ... Obsahujú až štyri orbitaly alebo 8 elektrónov. Pretože najbežnejšie používané prvky sú v druhej a tretej tretine, často sa používa oktetové pravidlo. Prvky tretej energetickej úrovne sú si veľmi podobné. Stále sa riadia oktetovým pravidlom, pretože hoci teraz existujú obežné dráhy s piatimi obežnými dráhami, obežnú dráhu nie je potrebné vyplňovať. Elektronická konfigurácia ukazuje, že 4s sa majú naplniť na 3d, takže nepotrebujú vyplniť orbitál d, takže sa zvyčajne riadia tiež oktetovým pravidlom. Prvky škrupiny tretej energetickej úrovne však nie sú na rozdiel od prvkov druhého riadku (pozri Gavinov odkaz na jedľu) pravidlom oktetu obmedzené. Môžu tvoriť hypervalentné molekuly v niektorých prípadoch, keď je d použitý na obežnej dráhe a naplnený. - to neplatí pre všetky zdanlivo hypervalentné molekuly, SF6 nie je hypervalentný, využíva slabé iónové väzby a polaritu, stále však existujú hypervalentné molekuly, vždy to bude závisieť od toho, ktorý stav je elektrostaticky vhodnejší. Na štvrtom plášti energetickej úrovne boli zavedené f-orbitaly, ale v tomto okamihu nie sme ani zďaleka plníme ich, pretože najskôr musíme vyplniť d-orbitaly. 5d orbitaly znamenajú 10 elektrónov a predchádzajúcich osem z pravidla oktetu ich má spolu až 18. Z tohto dôvodu je v periodickej tabuľke 18 stĺpcov. Teraz sa uplatňuje nové pravidlo, a to známe pravidlo s 18 elektrónmi, ktoré bolo spomenuté vyššie. Prechodné kovy sa tomuto pravidlu podriaďujú častejšie, aj keď niekedy sa ešte riadia oktetovým pravidlom. V tomto okamihu, keď je naplnených toľko orbitálov, a keď elektrostatika hrá úlohu v elektronickej konfigurácii, môžeme s určitými kovmi získať z rovnakého prvku rôzne katióny. Preto nerozoberajú počty oxidačných stavov s prechodnými kovmi, ako je to v prípade prvých troch riadkov tabuľky. Vynikajúci dánsky fyzik Niels Bohr (obr. 1) navrhol, že elektróny v atóme sa nemôžu pohybovať po žiadnych, ale po prísne definovaných obežných dráhach. V tomto prípade sa elektróny v atóme líšia svojou energiou. Pokusy ukazujú, že niektoré z nich sú priťahované k jadru silnejšie, iné naopak slabšie. Hlavným dôvodom sú rôzne vzdialenosti elektrónov od atómového jadra. Čím sú elektróny bližšie k jadru, tým sú k nemu silnejšie viazané a je ťažšie ich vytiahnuť z elektrónového obalu. S rastúcou vzdialenosťou od jadra atómu sa teda zvyšuje rezerva elektrónovej energie. Zdá sa, že elektróny pohybujúce sa v blízkosti jadra blokujú (skrínujú) jadro z iných elektrónov, ktoré sú k jadru priťahované slabšie a pohybujú sa od neho vo väčšej vzdialenosti. Takto sa vytvárajú elektronické vrstvy. Každá elektrónová vrstva pozostáva z elektrónov s podobnými energiami; preto sa elektronické vrstvy nazývajú aj energetické hladiny. Jadro sa nachádza v strede atómu každého prvku a elektróny, ktoré tvoria elektrónový obal, sú umiestnené okolo jadra vo vrstvách. Počet elektronických vrstiev v atóme prvku sa rovná počtu obdobia, v ktorom sa tento prvok nachádza. Napríklad sodík Na je prvkom 3. obdobia, čo znamená, že jeho elektrónový obal obsahuje 3 energetické úrovne. Atóm brómu Br má 4 energetické hladiny, pretože bróm sa nachádza vo 4. perióde (obr. 2). Model atómového sodíka: Model atómového brómu: Maximálny počet elektrónov v energetickej úrovni sa vypočíta podľa vzorca: 2n 2, kde n je počet energetických hladín. Maximálny počet elektrónov teda platí pre: 3 vrstvy - 18 atď. Pre prvky hlavných podskupín sa číslo skupiny, do ktorej prvok patrí, rovná počtu vonkajších elektrónov atómu. Vonkajšie elektróny sa nazývajú posledná elektrónová vrstva. Napríklad v atóme sodíka je 1 externý elektrón (pretože ide o prvok podskupiny IA). Atóm brómu má na poslednej elektrónovej vrstve 7 elektrónov (je to prvok podskupiny VIIA). Štruktúra elektronických škrupín prvkov 1-3 periód V atóme vodíka je jadrový náboj +1 a tento náboj je neutralizovaný jedným elektrónom (obr. 3). Ďalším prvkom po vodíku je hélium, tiež prvok 1. periódy. V dôsledku toho je v atóme hélia energetická hladina, kde sú umiestnené dva elektróny (obr. 4). Toto je maximálny možný počet elektrónov pre prvú energetickú hladinu. Bunka č. 3 je lítium. Atóm lítia má 2 elektronické vrstvy, pretože ide o prvok 2. periódy. Na jednej vrstve atómu lítia sú 2 elektróny (táto vrstva je úplná) a na druhej vrstve -1 elektrón. Atóm berýlia má o 1 elektrón viac ako atóm lítia (obr. 5). Podobne môžete znázorniť diagramy štruktúry atómov zvyšných prvkov druhej periódy (obr. 6). V atóme posledného prvku druhej periódy - neónu - je posledná energetická úroveň úplná (má 8 elektrónov, čo zodpovedá maximálnej hodnote pre 2. vrstvu). Neón je inertný plyn, ktorý nevstupuje do chemických reakcií, preto je jeho elektronický obal veľmi stabilný. Americký chemik Gilbert Lewis vysvetlil a predložil oktetové pravidlo, podľa ktorého je stabilná osem-elektrónová vrstva(s výnimkou 1 vrstvy: pretože na nej nemôžu byť viac ako 2 elektróny, bude pre ňu stabilný dvoj elektrónový stav). Po neóne prichádza prvok 3. obdobia - sodík. Atóm sodíka má 3 elektrónové vrstvy, na ktorých je umiestnených 11 elektrónov (obr. 7). Obrázok: 7. Schéma štruktúry atómu sodíka Sodík je v skupine 1, jeho valencia v zlúčeninách je I, ako v lítiu. Je to spôsobené tým, že na vonkajšej elektrónovej vrstve atómov sodíka a lítia je 1 elektrón. Vlastnosti prvkov sa periodicky opakujú, pretože atómy prvkov periodicky opakujú počet elektrónov na vonkajšej elektrónovej vrstve. Štruktúru atómov zvyšných prvkov tretej periódy možno znázorniť analogicky so štruktúrou atómov prvkov druhej periódy. Štruktúra elektronických škrupín zo 4 dobových prvkov Štvrté obdobie zahŕňa 18 prvkov, medzi nimi sú prvky ako hlavnej (A), tak aj sekundárnej (B) podskupiny. Znakom štruktúry atómov prvkov bočných podskupín je to, že sú postupne plnené predexternými (internými), a nie externými elektronickými vrstvami. Štvrté obdobie sa začína draslíkom. Draslík je alkalický kov, ktorý má v zlúčeninách valenciu I. To je v súlade s nasledujúcou štruktúrou jeho atómu. Ako prvok 4 má atóm draslíka 4 elektrónové vrstvy. Posledná (štvrtá) elektrónová vrstva draslíka obsahuje 1 elektrón, celkový počet elektrónov v atóme draslíka je 19 (poradové číslo tohto prvku) (obr. 8). Obrázok: 8. Schéma štruktúry atómu draslíka Po draslíku nasleduje vápnik. Atóm vápnika na vonkajšej elektrónovej vrstve bude mať 2 elektróny, ako je berýlium s horčíkom (sú tiež prvkami podskupiny II A). Ďalším prvkom po vápniku je skandium. Toto je prvok sekundárnej podskupiny (B). Všetky prvky sekundárnych podskupín sú kovy. Znakom štruktúry ich atómov je prítomnosť najviac 2 elektrónov na poslednej elektrónovej vrstve, t.j. nasledujúca posledná elektrónová vrstva bude postupne naplnená elektrónmi. Pre škandium si teda môžete predstaviť nasledujúci model štruktúry atómu (obr. 9): Obrázok: 9. Schéma štruktúry atómu škandia Takéto rozdelenie elektrónov je možné, pretože maximálny povolený počet elektrónov na tretej vrstve je 18, t. J. Osem elektrónov na tretej vrstve je stabilný, ale neúplný stav vrstvy. V desiatich prvkoch sekundárnych podskupín 4. periódy, od škandia po zinok, je postupne naplnená tretia elektrónová vrstva. Schéma štruktúry atómu zinku môže byť znázornená nasledovne: na vonkajšej elektrónovej vrstve - dva elektróny, na predvonkajšej vrstve - 18 (obr. 10). Obrázok: 10. Schéma štruktúry atómu zinku Prvky nasledujúce po zinku patria k hlavným prvkom podskupiny: gálium, germánium atď. Ku kryptónu. V atómoch týchto prvkov je postupne plnená 4. (t. J. Vonkajšia) elektrónová vrstva. V atóme inertného plynu kryptónu bude na vonkajšom obale oktet, to znamená stabilný stav. Zhrnutie lekcie V tejto lekcii ste sa naučili, ako funguje elektrónová škrupina atómu a ako vysvetliť jav periodicity. Zoznámili sme sa s modelmi štruktúry elektronických schránok atómov, pomocou ktorých je možné predvídať a vysvetľovať vlastnosti chemických prvkov a ich zlúčenín. Zoznam referencií Domáca úloha všetky úrovne valenčného pásma sú vyplnené. Všetky elektróny však nie sú schopné získať ďalšiu energiu na energetický skok. Iba malá časť elektrónov, ktoré osídľujú oblasť „rozmazania“ Fermi-Diracovej funkcie rádovo niekoľkých kT, môže opustiť svoje hladiny a prejsť do vyšších úrovní (obr. 8.7). V dôsledku toho sa iba malá časť voľných elektrónov nachádzajúcich sa vo vodivom pásme podieľa na vytváraní prúdu a môže prispievať k tepelnej kapacite kovu. Príspevok elektrónového plynu k tepelnej kapacite je zanedbateľný, čo je v súlade s Dulongovým a Petitovým zákonom.
všetky úrovne valenčného pásma sú vyplnené. Všetky elektróny však nie sú schopné získať ďalšiu energiu na energetický skok. Iba malá časť elektrónov, ktoré osídľujú oblasť „rozmazania“ Fermi-Diracovej funkcie rádovo niekoľkých kT, môže opustiť svoje hladiny a prejsť do vyšších úrovní (obr. 8.7). V dôsledku toho sa iba malá časť voľných elektrónov nachádzajúcich sa vo vodivom pásme podieľa na vytváraní prúdu a môže prispievať k tepelnej kapacite kovu. Príspevok elektrónového plynu k tepelnej kapacite je zanedbateľný, čo je v súlade s Dulongovým a Petitovým zákonom. ,
(8.9)
,
(8.9) ,
(8.10)
,
(8.10) , (8.11)
, (8.11) .
(8.12)
.
(8.12) .
(8.13)
.
(8.13) je to tak <
m >
v Sommerfeldovom vzorci stredná voľná dráha elektrónu s Fermiho energiou;
je to tak <
m >
v Sommerfeldovom vzorci stredná voľná dráha elektrónu s Fermiho energiou;  ,
(8.14)
,
(8.14) .
(8.15)
.
(8.15)
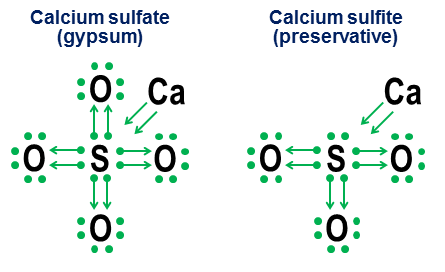












- História vzniku románu
- Ako nainštalovať ruštinu na iPhone
- Vyšetrovacie kódy qr strážnych psov
- Widescreen Fix - širokouhlé rozlíšenie pre Need for Speed: Most Wanted (2005) Mod pre nfs, ktoré sú najžiadanejšie pre rozlíšenie
- Ako pridať alebo odstrániť jazyk v systéme Windows XP, povoliť pravopis zľava a hieroglyfy
- Ako pridať jazyk na panel jazykov Windows
- Ako môžem pridať jazyk na panel jazykov v systéme Windows?

 Živý denník
Živý denník Facebook
Facebook Twitter
Twitter